Химические знаки элементов
Элементы принято обозначать химическими знаками (символами). По предложению шведского химика Берцелиуса (1813 г.) химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента; первая буква всегда прописная, вторая строчная. Например, водород (Hydrogenium) обозначается буквой H, кислород (Oxygenium) – буквой O, сера (Sulfur) – буквой S; ртуть (Hydrargyrum) – буквами Hg, алюминий (Aluminium) – Al, железо (Ferrum) – Fe и т. д.
Рис. 1. Таблица химических элементов с названиями на латинском и русском языке.
Русские названия химических элементов зачастую представляют собой латинские названия с видоизмененными окончаниями. Но также существует множество элементов, произношение которых отличается от латинского первоисточника. Это либо коренные русские слова (например, железо), либо слова, которые являются переводом (пример – кислород).
Как таблицу Менделеева пополнили ядерные элементы
 Здесь создают новые химические элементы
Здесь создают новые химические элементы
Вряд ли Менделеев предполагал, как далеко зайдут его последователи в поиске продолжения таблицы: в его время элементы получали только из природных материалов — минералов, руд.
Открытие ядерной реакции позволило создать новый способ «пополнения» таблицы: расщепление урана (элемент 92) позволило создать трансурановые элементы, вместе с которыми известно 118 элементов.
Все они не существуют в природе в достаточном для поиска количестве, либо имеют слишком короткий срок жизни. Для их получения ученые сталкивают атомы разных элементов (сегодня используют комбинацию «пучок атомов»->«мишень») , что приводит к их слиянию.
 Юрий Оганесян из НИЯУ МИФИ, соавтор открытия 5 трансурановых элементов
Юрий Оганесян из НИЯУ МИФИ, соавтор открытия 5 трансурановых элементов
Например, для создания теннесина (номер 117 соответствует числу протонов в ядре) ученые объединили пучки кальция (20 протонов) с мишенью из беркелия (97 протонов).
Синтез кальция с калифорнием (98) позволил появиться на свет долгоживущему изотопу оганесона (118).
Основные элементы
Таблица Менделеева состоит из следующих основных элементов:
- Элементы – вещества, состоящие из атомов одного и того же химического элемента.
- Атомы – наименьшие частицы, обладающие свойствами химических элементов.
- Периоды – горизонтальные ряды таблицы, которые разделяют элементы по количеству электронных оболочек.
- Группы – вертикальные столбцы таблицы, которые объединяют элементы с одинаковым количеством электронов на внешней электронной оболочке.
- Химические свойства – свойства, определяющие взаимодействие атомов разных элементов.
- Физические свойства – свойства, определенные состоянием и структурой атомов и молекул.
Эти основные элементы таблицы Менделеева позволяют упорядочить и классифицировать все известные химические элементы и облегчают их исследование и изучение.
Применение
Одно из основных применений воды — обеспечение выживаемости живых организмов. Вода является необходимой для поддержания жизни всех видов животных и растений. Она участвует во многих биологических процессах, включая дыхание, кровообращение, пищеварение и терморегуляцию.
Кроме того, вода используется в промышленности для производства различных товаров и услуг. Например, она является важным растворителем и используется в химической промышленности для получения различных соединений и продуктов. Вода также применяется в процессах охлаждения, парообразования, генерации электроэнергии и многих других.
Вода играет важную роль и в сельском хозяйстве. Она используется для полива растений, обеспечения животноводства и производства пищевых продуктов. Также вода является необходимой для санитарных и гигиенических целей, включая бытовые нужды, гигиену и очистку сточных вод.
Кроме приведенных выше применений, вода также используется в различных отраслях науки, технологии и быту. Она служит основой для приготовления пищи и напитков, создания различных растворов, охлаждения и увлажнения воздуха, очистки поверхностей и многое другое.
Таким образом, вода является важным и неотъемлемым компонентом нашей жизни и имеет множество значений и применений в различных сферах деятельности.
Символ 2: значение и применение
Водород является основным строительным блоком всех живых организмов и является необходимым для жизни. Он входит в состав воды (H2O) и многих органических соединений.
Водород также является важным элементом в производстве различных продуктов и технологий. Он используется в процессе получение энергии водородом водородных топливных элементах. Водородная энергия считается чистой и устойчивой, поэтому идет активное исследование и разработка водородных технологий для замены традиционных источников энергии.
Водород также используется в промышленности для производства аммиака, метанола и других химических соединений.
Октавы Ньюлендса
Очередную попытку систематизировать химические элементы по массам и свойствам, еще до того времени, когда была открыта периодическая система Менделеева, сделал ученый из Великобритании Ньюлендс. Он расположил их в порядке увеличения масс и заметил, что свойства повторяются через каждые семь. Такой закономерности он дал название закон октав, проведя аналогию с музыкальной гаммой.
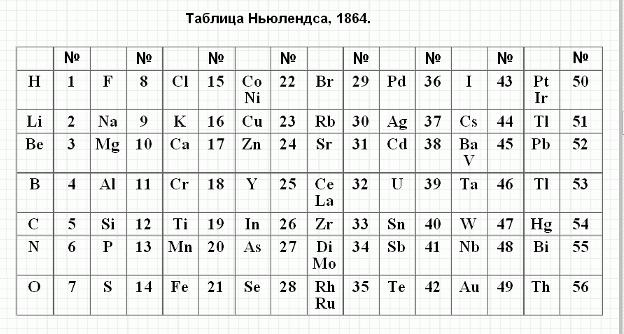
Однако эта зависимость распространялась только на элементы с небольшой атомной массой. В конечном итоге более тяжелые элементы пришлось расположить по несколько в одну ячейку, что было принято скептически.
Периодический закон Менделеева — в чём суть
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения — это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.
Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах
Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.
Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Иногда вещества получали название по имени его первооткрывателя, например, «глауберова соль» Na2SO4 *10H2O, открытая немецким химиком И. Р. Глаубером в XVII веке.
Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.
Рис. 3. А. Лавуазье.
Что мы узнали?
Все химические элементы имеют латинские корни. Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
-
/10
Вопрос 1 из 10
Периоды и группы
Таблица Менделеева представляет собой удобное и систематическое представление элементов, объединенных по их свойствам. В таблице элементы располагаются по горизонталям, называемым периодами. Всего в таблице 7 периодов.
Первый период состоит из двух элементов — водорода и гелия. Второй период состоит из восьми элементов, третий — из восьми, четвертый — из восемнадцати, пятый — из восемнадцати, шестой — из тридцати двух, седьмой — из тридцати двух элементов.
Колонки в таблице Менделеева называют группами, их всего 18. Группы представляют собой вертикальные столбцы, содержащие элементы с схожими свойствами. Элементы в одной группе имеют одинаковое количество электронов на внешней энергетической оболочке.
Элемент, находящийся в крайнем левом столбце, обладает одним электроном на внешней энергетической оболочке, и поэтому принадлежит к первой группе. Из крайнего правого столбца элементы обладают восемью электронами на внешней энергетической оболочке и поэтому относятся к восьмой группе.
Как использовать Таблицу Менделеева для определения химических элементов?
Таблица Менделеева — это основной инструмент, используемый химиками для классификации и организации химических элементов. Она представляет собой таблицу, в которой элементы расположены в порядке возрастания их атомных номеров и группируются по их химическим свойствам.
Для использования Таблицы Менделеева для определения химических элементов необходимо знать атомный номер или химический символ элемента, который вы хотите идентифицировать. Всего в таблице Менделеева 118 элементов, поэтому навигация по таблице может оказаться сложной задачей для новичков.
Существует несколько способов использования Таблицы Менделеева для определения химических элементов:
- Поиск элемента по атомному номеру: Если у вас есть атомный номер элемента, вы можете найти его, открыв таблицу Менделеева и находя соответствующий элемент в строке с нужным атомным номером.
- Поиск элемента по химическому символу: Если у вас есть химический символ элемента, вы можете найти его, открыв таблицу Менделеева и находя соответствующий символ в таблице. Химические символы указаны на каждой ячейке таблицы.
После нахождения нужного элемента в таблице Менделеева вы сможете узнать его химические свойства, атомную массу, электронную конфигурацию и другую информацию, которая может быть полезна при изучении и понимании химических процессов.
Таблица Менделеева — это не только инструмент для определения химических элементов, но и основа для понимания и изучения химии в целом. Знание и понимание структуры и организации таблицы Менделеева является основополагающим для успешного изучения химии и проведения химических исследований.
Основные принципы построения Таблицы Менделеева
Она представляет собой систематическое упорядочение всех известных химических элементов, которое позволяет наглядно представить их свойства и химические соединения.
Основные принципы построения Таблицы Менделеева:
1. Систематическое расположение элементов по порядку возрастания атомного номера
Каждый химический элемент в таблице имеет свой уникальный атомный номер, который определяется числом протонов в ядре атома элемента.
Элементы располагаются в порядке возрастания атомного номера слева направо и сверху вниз.
2. Группировка элементов по периодам и группам
В Таблице Менделеева элементы группируются по периодам и группам. Периоды образуют горизонтальные строки, а группы — вертикальные столбцы.
Каждая группа содержит элементы с похожими химическими свойствами и общей конфигурацией электронных оболочек.
Обычно элементы одной группы имеют одинаковое количество валентных электронов.
Внепериодические группы: В таблице есть несколько групп, которые располагаются вне основной части и не соответствуют своему атомному номеру.
Эти группы являются переходными металлами, лантаноидами и актиноидами.
3. Упорядочение элементов по возрастанию атомной массы
Внутри каждой группы элементы также упорядочены по возрастанию атомной массы.
Атомная масса — это средняя масса всех изотопов элемента, учитывая их относительную распространенность.
Таблица Менделеева является ключевым инструментом не только для химиков, но и для многих других областей науки и технологии.
Она позволяет предсказывать свойства и взаимодействия различных элементов, основываясь на их положении в таблице.
Химические свойства элементов
- Элементы таблицы Менделеева имеют свои характерные химические свойства, которые определяют их реакционную способность и возможность образования соединений.
- Внешние электронные оболочки элементов играют ключевую роль в определении их химических свойств.
- Металлы, расположенные в левой части таблицы Менделеева, обладают свойствами активных элементов. Они обычно сильно реагируют с кислородом, образуют щелочные оксиды и гидроксиды, а также способны отдавать электроны при реакциях.
- Неметаллы, расположенные в правой части таблицы Менделеева, обладают свойством различной степени активности, но в целом они проявляют кислотные свойства. Они чаще всего образуют кислотные оксиды и реагируют с основаниями.
- В периодической системе есть группы элементов, которые называют благородными газами. Они имеют очень низкую активность и реакционную способность.
- Ряд элементов, называемый переходными металлами, находится между группами 2 и 13-18 в таблице Менделеева. Эти металлы обладают различными химическими свойствами, включая свойства как металлов, так и неметаллов.
- Существуют также элементы-полуметаллы, такие как кремний или германий, которые обладают свойствами и металлов, и неметаллов в зависимости от условий.
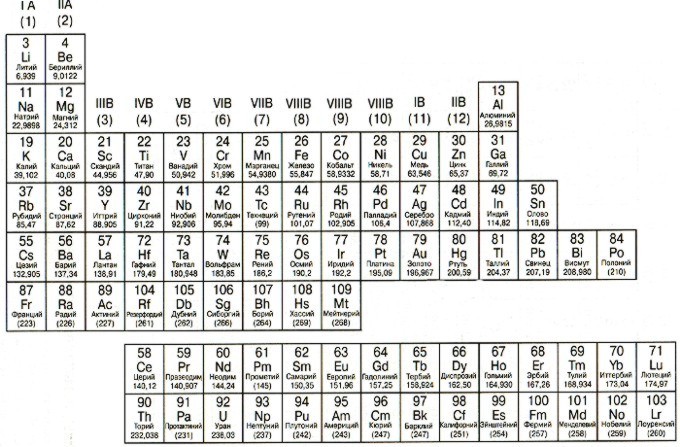
Таблица Менделеева с выделением s-, p-, d-, f- элементов
Разными цветами в данном варианте таблицы Менделеева отмечены s-, p-, d- и f- элементы. Напоминаю, что элемент относится к одному из этих типов, если внешние электроны в атоме данного элемента находятся соответственно на s-, p-, d- или f- подуровне. Например, электронная формула натрия имеет вид: 1s2s2s22p63s1. Внешний электронный уровень — 3s, следовательно, натрий относится к s-элементам. Электронная формула кислорода: 1s2s2s22p4. Внешний электронный подуровень — 2p, значит кислород — это р-элемент.
Свойства элементов из этих 4 групп отличаются достаточно сильно. Например, среди d-элементов присутствуют только металлы, а большинство неметаллов относятся к p-элементам.
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 |
1 |
1 |
2 |
|||||||
| 2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
| 3 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
| 4 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
|||
| 5 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
|
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
|||
| 6 |
55 |
56 |
57 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
|
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
|||
| 7 |
87 |
88 |
89 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||
| Водородные соед. | RH4 | RH3 | H2R | HR |
| *Лантаноиды |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
| ^Актиноиды |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
| s-элементы | p-элементы | d-элементы | f-элементы |
 А>
А>
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Иногда вещества получали название по имени его первооткрывателя, например, «глауберова соль» Na 2 SO 4 *10H 2 O, открытая немецким химиком И. Р. Глаубером в XVII веке.

Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.

Рис. 3. А. Лавуазье.
Примечания
- Периодическая система элементов / Д. Н. Трифонов // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1975. — Т. 19 : Отоми — Пластырь. — С. 413—417
- Professor Witek Nazarewicz. Researchers Explore Limits of the Periodic Table of Elements. Sci-News.com (20 июня 2018)
- Трифонов Д. Н. Структура и границы периодической системы. — М.: Атомиздат, 1969. — 271 с.
- Химики предложили улучшить таблицу Менделеева. Lenta.Ru (7 октября 2009).
- Messler, R. W. The essence of materials for engineers (англ.). — Sudbury, MA: Jones & Bartlett Publishers (англ.)рус., 2010. — P. 32. — ISBN 0763778338.
- Bagnall, K. W. (1967), Recent advances in actinide and lanthanide chemistry, in Fields, PR & Moeller, T, Advances in chemistry, Lanthanide/Actinide chemistry, vol. 71, American Chemical Society, с. 1–12
- Day M. C., Selbin J. Theoretical inorganic chemistry (англ.). — 2nd. — New York, MA: Reinhold Book Corporation, 1969. — P. 103. — ISBN 0763778338
- Holman J., Hill G. C. Chemistry in context (англ.). — 5th. — Walton-on-Thames: Nelson Thornes, 2000. — P. 40. — ISBN 0174482760.
- Mascetta, Joseph. Chemistry The Easy Way. — 4th. — New York: Hauppauge, 2003. — С. 50. — ISBN 978-0-7641-1978-1.
- Kotz, John; Treichel, Paul; Townsend, John. Chemistry and Chemical Reactivity, Volume 2 (англ.). — 7th. — Belmont: Thomson Brooks/Cole, 2009. — P. 324. — ISBN 978-0-495-38712-1.
- Jones, Chris. d- and f-block chemistry. — New York: J. Wiley & Sons, 2002. — С. 2. — ISBN 978-0-471-22476-1.
- Chang, Raymond. Chemistry. — 7. — New York: McGraw-Hill Education, 2002. — С. 289—310; 340—42. — ISBN 0-07-112072-6.
- Yoder, C. H.; Suydam, F. H.; Snavely, F. A. Chemistry. — 2nd. — Harcourt Brace Jovanovich (англ.)рус., 1975. — С. 58. — ISBN 0-15-506465-7.
- Крицман В. А., Станцо В. В., Энциклопедический словарь юного химика, 1990, с. 180.
История таблицы Менделеева
Великий русский ученый Дмитрий Иванович Менделеев разработал структуру элементов, расположение которых в таблице определялось их свойствами, зависящих от молекулярной массы. В таблице присутствовали незаполненные поля, позднее туда были вписаны предсказанные Менделеевым химические элементы. Ученый предсказал их свойства, позднее его прогнозы подтвердились. Всего в таблице присутствует 118 химических элементов. Элементы 1-90 присутствуют в природе, 28 синтезируются в лабораторных условиях. Таблица постоянно дорабатывалась и дополнялась. После совместной работы с химиком У. Рамзаем в таблицу были внесены инертные газы. Открытия в физике также используются для совершенствования таблицы. Работа над классификацией химических элементов не прекращается.
Таблицы Менделеева позволила добиться следующих результатов:
- систематизация информации об уже открытых элементах;
- возможность прогнозирования открытия новых элементов;
- развитие новых разделов физики.
В первоначальном виде таблица отражала природный порядок. Какие-либо объяснения отсутствовали. Настоящий смысл порядка расположения химических элементов прояснился после открытия квантовой физики.
Легенды и правда
Менделеев работал над созданием таблицы около 20 лет. Основная идея сложилась у ученого давно, долгие годы ушли на отражение результатов в виде таблицы. Ситуация осложнялась тем, что некоторые элементы к тому времени еще не были известны. Легенда о том, что таблица приснилась ученому во сне, была опровергнута самим ученым. Соратник Менделеева А. А. Иностранцев упоминает о том, что после сна ученый быстро набросал на листе бумаги готовую таблицу. Этому предшествовали три бессонных суток, на протяжении которых Дмитрий Иванович перебирал карточки с элементами, располагал их в определенной последовательности. Каждый элемент был выписан на отдельный листок. Ученый комбинировал карточки в зависимости от их характеристик.
Дмитрий Иванович был любителем пасьянсов. Ученый предположил, что все химические элементы обладают схожими свойствами, что позволяет объединять их в категории по аналогии с делением карт на масти. Его догадки были подтверждены. В правой части таблицы располагаются элементы, легко образующие соединения с другими веществами. В левом столбце находятся вещества, которые плохо вступают в химические реакции. Создание таблицы по принципу деления на классы упрощает изучение химии.
Уникальные свойства и применение элементов из группы 3839
Группа 3839 в таблице Менделеева объединяет элементы, обладающие уникальными свойствами и применяемые в различных областях науки и промышленности.
Данные элементы, включающие кирпичель, подтяжку и реверсию, в значительной степени расширяют возможности использования материалов и снабжают нас необходимыми и полезными свойствами для множества применений.
Ниже приведены некоторые уникальные свойства и применение элементов из группы 3839:
-
Кирпичель — элемент, обладающий высокой износостойкостью и водонепроницаемостью. Он широко используется в строительстве для создания прочных и долговечных стен и перекрытий.
-
Подтяжка — элемент, обладающий высокой прочностью и способностью к растяжению. Он используется в машиностроении и технике для крепления и укрепления различных конструкций.
-
Реверсия — элемент, обладающий способностью менять направление движения силы. Он применяется в электротехнике и механике для создания устройств, обеспечивающих изменение направления энергии или сигнала.
Элементы из группы 3839 играют важную роль в современной технологии и находят применение во многих областях науки и промышленности. Их уникальные свойства позволяют создавать новые материалы и технологии, обеспечивая нам удобство и прочность в повседневной жизни.
Характеристика элемента по его положению в периодической системе
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
Первое, что нам необходимо знать — это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
ВаO + SO3 → ВаSO4
Ва(ОН)2 + SO3 → ВаSO4 + H2O
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
SrO + H2SO4→ SrSO4 + H2O
Sr(OH)2 + H2SO4 → SrSO4 + 2H2O
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.
Триады Деберейнера
Первая попытка систематизировать элементы была сделана еще в 1829 году немецким химиком Деберейнером. Он объединил некоторые элементы с общими свойствами в группы по три, назвав их триадами. Смысл этого закона заключался в том, что в каждой триаде масса среднего элемента была приблизительно равна среднему арифметическому между массами крайних элементов.
Такое представление было слишком далеко от совершенства, но уже являлось прообразом менделеевской системы. Проблема заключалась в ограничении групп всего тремя элементами, что подошло не для всех из них, даже известных на тот момент. Однако этот закон показал, что имеется какая-то связь между массами элементов и их химическими свойствами.
Металлы, неметаллы, металлоиды
Металлы
Металлы расположены в Периодической таблице слева от ступенчатой диагональной линии, которая начинается с Бора (В) и заканчивается полонием (Po) (исключение составляют германий (Ge) и сурьма (Sb). Нетрудно заметить, что металлы занимают бОльшую часть Периодической таблицы. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны.
Неметаллы
Элементы, расположенные справа от ступенчатой диагонали B-Po, называются неметаллами. Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
Металлоиды
Между металлами и неметаллами находятся полуметаллы (металлоиды). Для них характерны свойства как металлов, так и неметаллов. Основное применение в промышленности полуметаллы нашли в производстве полупроводников, без которых немыслима ни одна современная микросхема или микропроцессор.

























