Роль катализаторов
Катализаторы играют важную роль в каталитических реакциях. Они повышают скорость химических реакций, не изменяя при этом своей концентрации в системе. Катализаторы обеспечивают эффективный путь протекания реакции, снижая энергию активации и ускоряя образование продуктов.
Катализаторы могут быть одноэлементными или многоэлементными соединениями. Они могут быть представлены металлами, оксидами, солями или комплексами. Выбор оптимального катализатора зависит от конкретной реакции и условий ее протекания.
Катализаторы могут действовать по разным механизмам. Некоторые катализаторы поглощают одну или несколько веществ, их поверхность служит местом протекания реакции. Другие катализаторы активируют молекулы реагентов, изменяя их электронную структуру и создавая благоприятные условия для реакции. Также существуют катализаторы, ускоряющие отдельные этапы реакции, например, десорбцию продуктов или регенерацию активной поверхности.
Катализаторы широко используются в промышленности, в процессах, таких как производство полимеров, производство удобрений, производство катализаторов самого. В лаборатории катализаторы применяются для проведения химических реакций, упрощения их условий и снижения стоимости. Катализаторы также нашли применение в различных отраслях, например, в автомобилестроении, где они используются для очистки выхлопных газов от вредных примесей.
| Преимущества катализаторов: | Недостатки катализаторов: |
|---|---|
|
|
Таким образом, катализаторы играют важную роль в химических реакциях, обеспечивая их более эффективное и экономичное протекание. Использование катализаторов позволяет снизить требуемую энергию и условия проведения реакции, что является важным фактором в современной науке и промышленности.
Производство серной кислоты
В качестве серосодержащего сырья для производства серной кислоты могут быть использованы сера или сероводород (побочные продукты нефтепереработки), минерал пирит FeS2, а также сульфиды некоторых других d-элементов. Никакие другие виды сырья не используются.
В настоящий момент основным сырьем для производства серной кислоты являются сероводород и сера, поскольку они в огромных количествах образуются в качестве побочных продуктов нефтепереработки.
Однако же в школьной программе пока еще по-прежнему считается, что серная кислота производится преимущественно из пирита, в связи с чем и мы будем рассматривать основные стадии производства серной кислоты именно этого же сырья.
Первая стадия
Заключается в сжигании предварительно измельченного пирита в токе обогащенного кислородом воздуха. Процесс протекает в соответствии с уравнением:
Обжиг осуществляют при температуре около 800 оС в печи для обжига. В процессе обжига используют так называемый метод кипящего слоя – частицы измельченного пирита подаются в печь сверху, а воздух — снизу. В результате этого раскаленные частицы пирита оказываются подвешенными в токе воздуха, внешне напоминая кипящую жидкость.
После обжига пирита полученный печной газ, содержащий диоксид серы, отделяется от твердых примесей огарка (Fe2O3) с помощью циклона. Циклоном называют аппарат, в котором происходит грубая очистка печных газов за счет центробежной силы от наиболее крупных твердых частиц. Далее после грубой очистки смесь газов проходит более глубокую очистку уже от оставшихся мелких твердых частиц с помощью электрофильтра. Принцип действия электрофильтра основан на том, что к наэлектризованным металлическим пластинам прилипает пыль, которая после скопления ссыпается с них под собственным весом в приемник.
После очистки от твердых примесей печной газ направляется в нижнюю часть так называемой сушильной башни, в верхнюю часть которой впрыскивается концентрированная серная кислота на встречу газу. При таком варианте осуществления фактически сталкиваются два потока — смеси газов, идущей снизу, и струи жидкой концентрированной серной кислоты, текущей сверху. Очевидно, что в результате этого достигается максимальная степень «смешения» газа с осушающей жидкостью. Данный прием носит название принципа противотока.
Вторая стадия
После очистки от твердых примесей и осушки концентрированной серной кислотой газы поступают в контактный аппарат. В контактном аппарате расположены полки с катализатором V2O5, который катализирует взаимодействие диоксида серы с кислородом в соответствии с уравнением:
Аналогично реакции взаимодействия азота с водородом, рассмотренной выше, данная реакция также является каталитической, экзотермической и протекает с уменьшением количества газообразных веществ. Поэтому с точки зрения принципа Ле Шателье ее следовало бы проводить при низких температурах. Однако при низких температурах скорость реакции крайне низка, и ее осуществляют при оптимальной температуре около 400-500 оС. Смещения равновесия реакции в сторону разложения SO3 при повышении температуры удается практически полностью избежать, проводя реакцию при повышенном давлении.
Третья стадия (заключительная)
После второй стадии образовавшийся триоксид серы поступает в часть установки, называемую поглотительной башней.
Из названия данного аппарата логичным было бы предположить, что триоксид серы в нем поглощается в этой части установки водой, ведь триоксид серы, взаимодействуя с водой, образует серную кислоту. Однако в реальности серный ангидрид SO3поглощают не водой (!!!), а концентрированной серной кислотой. Связано это с тем, что при смешении серного ангидрида с водой выделяется колоссальное количество теплоты, в результате чего сильно возрастают температура, давление и образуются мельчайшие капли трудноуловимого сернокислотного тумана.
В результате поглощения SO3 концентрированной серной кислотой фактически образуется раствор SO3 в безводной серной кислоте, который называют олеумом. Далее образующийся олеум собирается в металлические емкости и отправляется на склад. Серную кислоту необходимой концентрации получают, добавляя к олеуму воду в нужной пропорции. В результате добавления воды избыток SO3 превращается в серную кислоту.
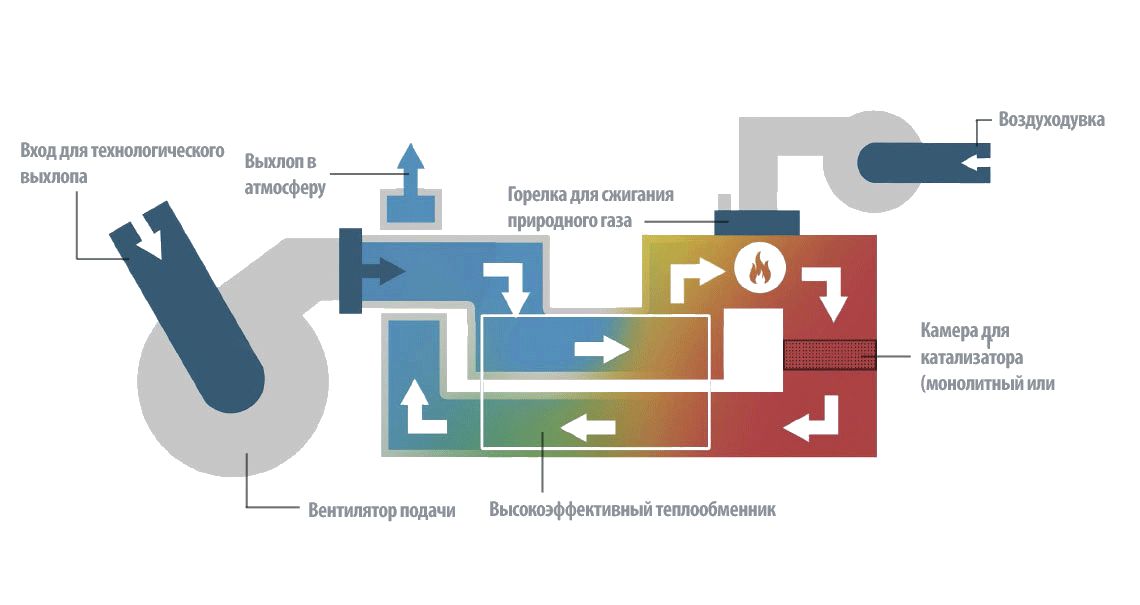
Функционирование/принцип действия каталитического окислителя
Каталитическое окисление работает аналогично другим термическим технологиям (таким как каталитические нейтрализаторы оксида азота или каталитические термические окислители) для очистки выбросов летучих органических соединений. Отличие от других систем заключается в том, что газ направляется в керамический слой для получения тепла, которое будет использоваться для окисления непосредственно после прохождения через зону пламени.
Каталитическое окисление разрушает летучие органические соединения (ЛОС), превращая их в CO2 и H2O в реакторе каталитического окисления. Процесс проводят в присутствии катализатора в камере сгорания, где ЛОС разрушается при температуре в диапазоне 250-350°С, значительно ниже тех, которые используются при регенеративном термическом окислении. Однако катализатор со временем деактивируется и должен заменяться каждые 4-5 лет, что увеличивает эксплуатационные расходы.
Каталитическое окисление имеет тепловую эффективность более 98% и не потребляет газ при достижении автотермической точки. Это идеальный метод для низких или средних воздушных потоков (1000-30 000 нм3/ч) при средней или низкой концентрации летучих органических соединений (ЛОС) (0,1 – 10 г/нм3), при этом имеет низкие эксплуатационные расходы.
В качестве катализаторов обычно используются благородные металлы (платина, палладий, серебро или золото, сплавы с титаном, родием, осмием или иридием), нанесенные на керамическую основу, или оксиды металлов (оксиды ванадия, хрома, марганца, железа, кобальта, никеля или меди и др.). Катализаторы на основе благородных металлов обладают более высокой активностью, чем катализаторы из оксидов металлов, хотя и обладают более низкой устойчивостью к загрязнениям.
Металлооксидные катализаторы используются для окисления газов, содержащих хлорированные соединения. Катализаторы на основе платины (как и используемые при каталитическом окислении аммиака) активны при окислении летучих органических соединений (ЛОС), содержащих серу, хотя они быстро дезактивируются в присутствии хлора.
Наличие вредных для катализаторов веществ в обрабатываемом газе оказывает существенное влияние на срок их полезного использования. Вредными для катализаторов веществами являются фосфор, мышьяк, галогены, свинец, сера и кремний, и др. Газовые потоки с этими веществами должны быть удалены путем предварительной обработки, иначе они не будут пригодны для каталитического окисления.
Каталитическое окисление диоксида серы, метана, алканов или монооксида углерода требует различных подходов в зависимости от источника выбросов.
Роль катализатора
Катализатор – это вещество, которое ускоряет химическую реакцию или обеспечивает ее возможность, не участвуя при этом самостоятельно в реакции. Наличие катализатора может существенно изменить кинетику реакции, позволяя ей протекать при более низких температурах или в условиях, при которых реакция без катализатора вообще не может протекать.
Основная роль катализатора в каталитическом окислении – ускорение реакции окисления. Катализатор снижает энергию активации реакции, что позволяет ей протекать при более низкой температуре, чем без катализатора. Благодаря этому процесс окисления может протекать более эффективно и экономично.
Катализаторы могут быть разных типов. Например, гомогенные катализаторы находятся в одной фазе с реагентами и образуют однородную смесь. Гетерогенные катализаторы находятся в разных фазах с реагентами и образуют гетерогенную систему.
Кроме того, катализаторы могут быть регенерируемыми или нет. Регенерируемые катализаторы могут восстанавливать свою активность после проведения реакции, а нерегенерируемые – не могут
Это важное свойство, которое влияет на экономическую эффективность процесса каталитического окисления
Применение катализаторов в каталитическом окислении имеет широкий спектр. Они используются в промышленности для производства различных химических веществ, таких как аммиак, синтезгаз, синтетические полимеры и другие. Катализаторы также играют важную роль в очистке воды и воздуха, а также в процессах сжигания топлива.
Примеры катализаторов
Тип катализатора
Примеры
Гомогенные катализаторы
Хлорид меди (II) в присутствии гидроксида натрия
Гетерогенные катализаторы
Платина на активном угле
В заключение, катализаторы играют ключевую роль в процессе каталитического окисления. Они ускоряют реакцию, снижая энергию активации, и позволяют проводить реакцию при более низкой температуре и экономичнее. Применение катализаторов имеет широкий спектр в промышленности и окружающей среде.
↑йЮРЮКХРХВЕЯЙЮЪ УХЛХЪ ДКЪ НУПЮМШ НЙПСФЮЧЫЕИ ЯПЕДШ
нДМХЛ ХГ МЮХАНКЕЕ БЮФМШУ ЙНЛОНМЕМРНБ ЦКНАЮКЭМНЦН ЩЙНКНЦХВЕЯЙНЦН ЙПХГХЯЮ ЪБКЪЕРЯЪ ГЮЦПЪГМЕМХЕ ЮРЛНЯТЕПШ, ОНБЕПУМНЯРМШУ БНД Х ОНВБШ. уХЛХВЕЯЙЮЪ Х МЕТРЕУХЛХВЕЯЙЮЪ ОПНЛШЬКЕММНЯРЭ БМНЯЪР ЯСЫЕЯРБЕММШИ, УНРЪ Х МЕ ЦКЮБМШИ БЙКЮД Б ЩРН ГЮЦПЪГМЕМХЕ.
оЕПБЮЪ ОПХВХМЮ БНГМХЙМНБЕМХЪ НРУНДНБ Б УХЛХВЕЯЙНИ Х ЯЛЕФМШУ НРПЮЯКЪУ ОПНЛШЬКЕММНЯРХ ЯНЯРНХР Б РНЛ, ВРН БН ЛМНЦХУ ЯКСВЮЪУ ЯШПЭ╦ ХЛЕЕР ЯКНФМШИ ЯНЯРЮБ Х МЕ БЯЕ ЕЦН ЙНЛОНМЕМРШ ЛНФМН ХЯОНКЭГНБЮРЭ; НВЕМЭ ВЮЯРН ОНКСВЕМХЕ ЖЕКЕБНЦН ОПНДСЙРЮ ЯНОПНБНФДЮЕРЯЪ НАПЮГНБЮМХЕЛ НРУНДНБ, ЙНРНПШЕ МЕ СДЮ╦РЯЪ ЙБЮКХТХЖХПНБЮММН ОПХЛЕМХРЭ. мЮХАНКЕЕ ЪПЙХЛ ОПХЛЕПНЛ РЮЙНЦН ОНКНФЕМХЪ ДЕК ЪБКЪЕРЯЪ ПЮАНРЮ ЖЕККЧКНГМН-АСЛЮФМШУ ЙНЛАХМЮРНБ. дПЕБЕЯХМЮ, ХДСЫЮЪ МЮ ОПНХГБНДЯРБН АСЛЮЦХ ЯНЯРНХР ХГ ДБСУ НЯМНБМШУ ЙНЛОНМЕМРНБ – ЖЕККЧКНГШ Х КХЦМХМЮ, ЯНДЕПФЮМХЕ ЙНРНПШУ Б ЯШПЭЕ ОПХЛЕПМН НДХМЮЙНБН. еЯКХ ЖЕККЧКНГЮ ОНКМНЯРЭЧ ХД╦Р Б ДЕКН, РН КХЦМХМ ОНВРХ МЕ МЮУНДХР ОПХЛЕМЕМХЪ, ВРН ОПХБНДХР Й НАПЮГНБЮМХЧ ЛМНЦНВХЯКЕММШУ НРБЮКНБ.
оПХПНДМШИ ЦЮГ, ДНАШБЮЕЛШИ МЮ ЛМНЦХУ НРЕВЕЯРБЕММШУ ЛЕЯРНПНФДЕМХЪУ, ЯНДЕПФХР ЯЕПНБНДНПНД Х ЯЕПЮНПЦЮМХВЕЯЙХЕ ЯНЕДХМЕМХЪ. вРНАШ ОПХПНДМШИ ЦЮГ ЛНФМН АШКН ХЯОНКЭГНБЮРЭ ЙЮЙ РНОКХБН ХКХ ЙЮЙ УХЛХВЕЯЙНЕ ЯШПЭ╦, НМ НАЪГЮРЕКЭМН ДНКФЕМ АШРЭ НВХЫЕМ НР ЯНЕДХМЕМХИ ЯЕПШ. б ПЕГСКЭРЮРЕ ЯЙЮОКХБЮЧРЯЪ «ГЮКЕФХ» ЩКЕЛЕМРМНИ ЯЕПШ, НАЗ╦Л ЙНРНПШУ ЯНЯРЮБКЪЕР ЛХККХНМШ РНММ.
бРНПЮЪ ОПХВХМЮ ГЮЙКЧВЮЕРЯЪ Б РНЛ, ВРН ОПЮЙРХВЕЯЙХ МЕР УХЛХВЕЯЙХУ ОПНЖЕЯЯНБ, ЙНРНПШЕ АШ ОПНХЯУНДХКХ ЯН 100%-И ЯЕКЕЙРХБМНЯРЭЧ. оПХ ЯЕКЕЙРХБМНЯРХ 95% – Ю ЩРН НВЕМЭ БШЯНЙНЕ ГМЮВЕМХЕ – 5% ЯШПЭЪ ОПЕБПЮЫЮЧРЯЪ Б МЕМСФМШИ, ГЮВЮЯРСЧ ЩЙНКНЦХВЕЯЙХ НОЮЯМШИ ОПНДСЙР. еЦН МЕЛМНЦН, ЕЯКХ ОПНХГБНДХРЕКЭМНЯРЭ ОПНЖЕЯЯЮ ЯНЯРЮБКЪЕР ДЕЯЪРЙХ РНММ Б ЦНД, Ю ЕЯКХ ЛХККХНМШ?
хГ ЯЙЮГЮММНЦН ОНМЪРМН, ВРН ЦКЮБМЮЪ ГЮДЮВЮ ЙЮРЮКХРХВЕЯЙНИ УХЛХХ ОПХЛЕМХРЕКЭМН Й ЩЙНКНЦХВЕЯЙХЛ ОПНАКЕЛЮЛ, – ПЮГПЮАНРЙЮ ЙЮРЮКХГЮРНПНБ, НАКЮДЮЧЫХУ ЛЮЙЯХЛЮКЭМН БШЯНЙНИ ЯЕКЕЙРХБМНЯРЭЧ. оНОШРЙЮЛХ ПЕЬХРЭ ЩРС ГЮДЮВС ГЮМЪРШ Б ЛХПЕ ЯНРМХ КЮАНПЮРНПХИ.
цКЮБМШЛ БХМНБМХЙНЛ ГЮЦПЪГМЕМХЪ ЮРЛНЯТЕПШ ЙПСОМШУ ЦНПНДНБ (ДН 80% НР НАЫЕИ БЕКХВХМШ) ЪБКЪЕРЯЪ ЮБРНЛНАХКЭМШИ РПЮМЯОНПР, БШУКНОМШЕ ЦЮГШ ЙНРНПНЦН ЯНДЕПФЮР ЛНМННЙЯХД СЦКЕПНДЮ, НЙЯХДШ ЮГНРЮ, МЕЯЦНПЕБЬЕЕ РНОКХБН, ЯЮФС. б ОНЯКЕДМЕЕ ДЕЯЪРХКЕРХЕ ОНКСВХКХ ЬХПНЙНЕ ПЮЯОПНЯРПЮМЕМХЕ МЕИРПЮКХГЮРНПШ БШУКНОМШУ ЦЮГНБ, ДЕИЯРБХЕ ЙНРНПШУ НЯМНБЮМН МЮ ЙЮРЮКХРХВЕЯЙНЛ ОПЕБПЮЫЕМХХ ян Б ян2, Ю НЙЯХДНБ ЮГНРЮ – Б ЯБНАНДМШИ ЮГНР. щРХ СЯРПНИЯРБЮ ОПЕДЯРЮБКЪЧР ЯНАНИ РПСАС, БМСРПХ ЙНРНПНИ МЮУНДХРЯЪ ЙЮРЮКХГЮРНП –
БШЯНЙНДХЯОЕПЯМШИ АКЮЦНПНДМШИ ЛЕРЮКК (ОКЮРХМЮ, ОЮККЮДХИ, ПНДХИ), МЮМЕЯ╦ММШИ МЮ АКНВМСЧ ЙЕПЮЛХВЕЯЙСЧ ХКХ ЮКЧЛХМХЕБСЧ ОНДКНФЙС. рЮЙХЕ ЙЮРЮКХРХВЕЯЙХЕ МЕИРПЮКХГЮРНПШ ДНБНКЭМН ДНПНЦХ, МН Я ХУ ОНЛНЫЭЧ ОПХ ОНБЯЕЛЕЯРМНЛ ОПХЛЕМЕМХХ СФЕ СДЮКНЯЭ ЯСЫЕЯРБЕММН ОНБШЯХРЭ ЙЮВЕЯРБН ЮРЛНЯТЕПМНЦН БНГДСУЮ БН ЛМНЦХУ ЕБПНОЕИЯЙХУ ЦНПНДЮУ.
еЫ╦ НДМН НВЕМЭ БЮФМНЕ МЮОПЮБКЕМХЕ ЩЙНКНЦХВЕЯЙНЦН ЙЮРЮКХГЮ – ПЮГПЮАНРЙЮ ЙЮРЮКХГЮРНПНБ ДКЪ РЮЙ МЮГШБЮЕЛШУ РНОКХБМШУ ЩКЕЛЕМРНБ – ЩМЕПЦЕРХВЕЯЙХУ СЯРПНИЯРБ, ОПЕБПЮЫЮЧЫХУ УХЛХВЕЯЙСЧ ЩМЕПЦХЧ РНОКХБЮ (ОПЕФДЕ БЯЕЦН БНДНПНДЮ) МЮОПЪЛСЧ Б ЩКЕЙРПХВЕЯЙХИ РНЙ. яОЕЖХЮКХЯРШ ОНКЮЦЮЧР, ВРН Б НАНГПХЛНЛ АСДСЫЕЛ РНОКХБМШЕ ЩКЕЛЕМРШ МЮИДСР ЬХПНЙНЕ ОПХЛЕМЕМХЕ МЮ ЮБРНРПЮМЯОНПРЕ. оПЮБДЮ, ДКЪ ЩРНЦН ЯМЮВЮКЮ ДНКФМШ АШРЭ ПЕЬЕМШ ОПНАКЕЛШ ЙПСОМНЛЮЯЬРЮАМНЦН ОНКСВЕМХЪ ДЕЬ╦БНЦН Х ВХЯРНЦН БНДНПНДЮ Х УПЮМЕМХЪ ЩРНЦН ЦЮГЮ МЮ АНПРС ЮБРНЛНАХКЪ.
Применение в различных отраслях
Низкотемпературные катализаторы окисления широко применяются в различных отраслях промышленности и научных исследований. Их использование обусловлено их специфическими свойствами и преимуществами перед другими типами катализаторов.
Одной из основных отраслей, где находят применение эти катализаторы, является автомобильная промышленность. Низкотемпературные катализаторы окисления используются для очистки отработанных газов от вредных выбросов, таких как оксиды азота (NOx), углеводороды и другие загрязняющие вещества. Это помогает снизить вредное воздействие автомобильного транспорта на окружающую среду и улучшить экологическую обстановку в городах.
В производстве химических веществ низкотемпературные катализаторы окисления используются для проведения различных химических реакций, включая окисление органических соединений. Они позволяют эффективно осуществлять реакции при низких температурах, что снижает энергозатраты и увеличивает производительность процесса.
Кроме того, низкотемпературные катализаторы окисления используются в производстве энергии. Они применяются в основных источниках энергии, таких как электростанции, для улавливания и сжигания отходов, позволяя при этом снизить выбросы загрязняющих веществ в атмосферу.
| Отрасль применения | Примеры конкретных приложений |
|---|---|
| Автомобильная промышленность | Каталитические системы автомобильных выхлопных систем |
| Химическая промышленность | Синтез органических соединений с использованием низких температур |
| Энергетика | Улавливание и сжигание отходов на электростанциях |
Таким образом, низкотемпературные катализаторы окисления играют важную роль в различных отраслях, способствуя эффективному использованию ресурсов, снижению вредного воздействия на окружающую среду и повышению качества производства.
Реакция активации катализатора
Процесс каталитического окисления сжигания возможен благодаря активации катализатора. Реакция активации катализатора включает в себя следующие этапы:
1. Адсорбция и диссоциация газов
Первый этап реакции активации катализатора — адсорбция и диссоциация газов. Катализатор притягивает молекулы газа на свою поверхность и разбивает их на отдельные атомы или ионы. Этот этап позволяет увеличить присутствие активных частиц на поверхности катализатора.
2. Активация кислорода
Второй этап реакции — активация кислорода. Кислород играет ключевую роль в окислительном процессе. Под воздействием катализатора кислородные молекулы подвергаются изменениям и становятся более активными для окисления других веществ.
3. Реакция окисления
Третий этап реакции — реакция окисления. На поверхности катализатора происходит взаимодействие активированного кислорода с газами, содержащими летучие органические соединения или другие вещества, подвергающиеся окислению. В результате этого процесса происходит выделение тепла и продуктами окисления становятся вода и углекислый газ.
Реакция активации катализатора является необходимым этапом процесса каталитического окисления сжигания и позволяет значительно увеличить скорость реакции сжигания и эффективность процесса.
Образование конечных продуктов реакции
Принцип каталитического окисления сжигания основан на активном взаимодействии каталитического окислителя с топливом в наличии определенной температуры и кислородного запаса. В результате реакции окисления топлива каталитическим окислителем образуются конечные продукты, которые зависят от состава и свойств используемых топлива и каталитического окислителя.
Основными конечными продуктами реакции в случае сжигания углеводородов являются:
- Углекислый газ (СO2) — основной продукт полного окисления углерода в соединении с кислородом.
- Вода (H2O) — образуется в результате полного окисления водорода.
Помимо основных продуктов, при сгорании топлива также могут образовываться:
- Оксиды азота (NOx) — образуются при высоких температурах воздуха и наличии азота в топливе и окружающей среде.
- Пыль, дым, диоксид серы (SO2) и другие загрязнения воздуха — образуются при сжигании грязного топлива, содержащего нечистоты.
Каталитическое окисление сжигания позволяет уменьшить образование последних двух видов продуктов благодаря особой структуре и свойствам каталитического окислителя, который способствует полному окислению топлива и уменьшает образование оксидов азота и загрязнений воздуха.
Процесс сжигания
Каталитическое окисление сжигания основывается на использовании специального вещества – катализатора, который ускоряет химическую реакцию, не участвуя в ней самостоятельно и не изменяя своей структуры. Катализатор создает условия для окисления вещества, что приводит к его сгоранию.
Процесс сжигания с катализатором происходит в специальном реакторе, где устанавливаются определенные условия – температура, давление, наличие кислорода и присутствие катализатора. Вещество подвергается воздействию окислителя и катализатора, что приводит к его окислению и выделению тепла в процессе сжигания.
Каталитическое сжигание является одним из наиболее эффективных методов сжигания органических веществ, так как происходит при более низких температурах, чем при обычном сжигании, и не требует большого количества кислорода. Это позволяет снизить выбросы вредных веществ и улучшить экологическую обстановку.
Важным аспектом каталитического сжигания является правильный выбор катализатора, который обладает высокой активностью и стабильностью. Катализаторы могут быть различной природы – металлическими, окисными, сульфидными и другими. Они должны обеспечивать эффективность и длительное время работы системы сжигания.
| Преимущества каталитического сжигания | Недостатки каталитического сжигания |
|---|---|
| – Снижение выбросов вредных веществ; | – Необходимость поддержания определенных условий; |
| – Экономия энергии; | – Сложность выбора и обслуживания катализатора; |
| – Уменьшение образования отходов; | – Высокие затраты на покупку и установку катализатора; |
Каталитическое сжигание находит применение в различных отраслях – промышленности, энергетике, автомобильном производстве и др. Внедрение этого принципа позволяет улучшить процессы сжигания, снизить вредные выбросы и обеспечить экологическую безопасность.
Каталитическое окисление — Catalytic oxidation
Каталитическое окисление — это процессы, при которых соединения окисляются с использованием катализаторов . Общие применения включают окисление органических соединений кислородом воздуха. Такие процессы проводятся в большом масштабе для очистки от загрязняющих веществ, производства ценных химикатов и производства энергии. В нефтехимии , промежуточные продукты высокой ценности , такие как карбоновые кислоты , альдегиды , кетоны , эпоксиды , и спирты получают путем частичного окисления алканов и алкенов с молекулярным кислородом . Эти промежуточные продукты необходимы для производства потребительских товаров. При частичном окислении возникают две проблемы. Во-первых, горение является наиболее предпочтительной реакцией между кислородом и углеводородами . Вторая проблема — это значительная трудность активации двуокиси кислорода, а именно. расщепление молекулы на составляющие ее атомы, имеющее энергетический барьер 498 кДж / моль. Обычная стратегия активации кислорода контролируемым образом заключается в использовании молекулярного водорода или монооксида углерода в качестве жертвенных восстановителей в присутствии гетерогенного катализатора, так что барьер активации снижается до 2 СН 3 ОН + О 2 → 2 СН 2 О + 2 Н 2 О
Это превращение происходит очень медленно в отсутствие катализаторов. Типичными катализаторами окисления являются оксиды металлов и карбоксилаты металлов .
Метод — каталитическое окисление
Метод каталитического окисления основан на каталитическом воздействии сераорганических соединений с кислородом и образовании легкоудаляемых соединений серы либо элементарной серы.
Метод каталитического окисления заключается в том, что над дегидрирующими катализаторами пары спирта пропускают в смеси с воздухом при температуре 500 — 600 С. При дегидрировании спирта образуются ацетальдегид и водород, последний немедленно окисляется кислородом воздуха в воду.
|
Схема установки очистки отходящих газов в производстве олифы. |
Метод каталитического окисления по сравнению с описанными выше является более простым в аппаратурном оформлении и позволяет обеспечить полную очистку газовых выбросов.
Метод межфазного каталитического окисления с помощью КМпО4 свободен от этих недостатков.
|
Схема производства двухатомных фенолов некаталитическим окислением диалкилбензолов ( фирма Distillers Co. |
Метод каталитического окисления диалкилбензолов разработан фирмой Goodyear-Rubber. Этой фирмой освоено производство гидрохинона ( 1 4-диокси-бензола) через дигидроперекись л-диизопропилбензола на установке мощностью 3000 т / год.
Разработан метод каталитического окисления пиридиновых соединений, содержащихся в сточных водах производства диви-нилметилвинилпиридинового каучука.
Использование метода каталитического окисления позволяет полностью очистить газовые выбросы от таких примесей, как масляный альдегид, ацетон, метиловый, этиловый, пропиловый и диа цетоновый спирты, фенол, толуол, ксилол, уайт-спирит, изоциана-ты, непредельные мономеры и др.. Очень эффективным оказалось применение в этом методе очистки медно-хромового катализатора, состоящего из смеси хромата ( 60 %) и хромита ( 30 %) меди с добавками оксидов меди, хрома и кальция. Процесс окисления ( до COz и воды) большинства перечисленных выше веществ происходит при 250 — 350 С.
Получают методом каталитического окисления циклогексана
Получается методом каталитического окисления бензола или нефтяных фракций.
Получается методом каталитического окисления бензола или нефтяных фракций.
Давно известен также метод каталитического окисления циклогексана в циклогексанол и цикло-гексанон кислородом воздуха ( ср. Таким образом, циклогексан, выделяемый из нефти, может быть непосредственно использован для синтеза капролактама.
Фирма Монсанто рекомендует метод каталитического окисления сернистого ангидрида с использованием ванадиевого катализатора для электростанций с установкой высокотемпературного ( 450 — 500 С) электрофильтра и контактного аппарата перед экономайзером.
В связи с развитием методов каталитического окисления пропилена акролеин является потенциально дешевым и доступным мономером.
В медицине
Каталитическое окисление находит широкое применение в медицине благодаря своим уникальным свойствам и возможностям. Ниже перечислены основные области медицины, в которых применяется каталитическое окисление:
- Диагностика заболеваний: Каталитическое окисление используется для создания чувствительных и специфичных биосенсоров и диагностических тест-систем. Благодаря этим методам, врачи могут быстро и точно обнаруживать различные патологии, такие как инфекции, рак и нарушения функций органов.
- Терапия заболеваний: Каталитическое окисление может быть также использовано для лечения различных заболеваний. Например, каталитическая окись водорода (водород пероксид) может быть применена для дезинфекции ран или лечения зубных заболеваний. Также проведение окислительных реакций на поверхности медицинских инструментов позволяет достичь стерильности и защитить пациента от инфекций.
- Биокомпатибельные материалы: Каталитическое окисление играет важную роль в разработке биокомпатибельных материалов, используемых в медицинских имплантатах. Эти материалы обладают высокой степенью поверхностной активности и способны специфически взаимодействовать с биологическими средами, повышая тем самым эффективность лечения и уменьшая риск отторжения имплантата организмом.
Каталитическое окисление имеет огромный потенциал в медицине и продолжает развиваться как сфера исследований и клинической практики. Благодаря этому методу, медицинская диагностика и терапия становятся более точными, эффективными и безопасными.
Окисление в присутствии катализаторов
В каталитическом окислении, катализаторы играют роль поверхности, на которой происходят реакции между окислителем и веществом, которое окисляется. Эта поверхность может быть выполнена в виде металла, оксида или наночастиц. Катализаторы обеспечивают активацию окислителя и сделают его реакционно способным к окислению вещества. Это происходит путем модификации окислителя или участниками самой реакции.
Каталитическое окисление находит применение во многих процессах, таких как производство пищевых продуктов, фармацевтических препаратов, пластмасс и топлива. Один из наиболее известных примеров каталитического окисления — это процесс преобразования углеводородных соединений водородом при помощи катализатора платины.
В промышленности
Каталитическое окисление играет важную роль в различных отраслях промышленности. Оно используется для получения различных продуктов, очистки отходов и обеспечения безопасности процессов.
Производство химических веществ
- Каталитическое окисление широко применяется в производстве органических кислот, спиртов, альдегидов и других химических веществ.
- Оно позволяет вести процессы синтеза с высокой эффективностью, снижая стоимость и время производства.
- Также каталитическое окисление используется для получения промежуточных продуктов, которые затем применяются в других отраслях химической промышленности.
Энергетика
- В энергетике каталитическое окисление применяется для очистки отходящих газов от сажи и других загрязнений.
- Очистка отходящих газов позволяет снизить загрязнение окружающей среды и повысить эффективность работы энергетических установок.
- Также каталитическое окисление используется в процессе обработки выхлопных газов автотранспорта для снижения выбросов вредных веществ.
Нефтехимия
- Каталитическое окисление применяется в процессах переработки нефти для получения высокоценных продуктов, таких как бензол, стирол и др.
- Оно позволяет получить продукты с заданными характеристиками и повысить эффективность переработки нефти.
Производство полимеров
- Каталитическое окисление применяется для синтеза полимеров с заданными свойствами.
- Оно позволяет контролировать процессы полимеризации и получить полимеры с определенной структурой и молекулярным весом.
- Кроме того, каталитическое окисление используется для очистки отходов, образующихся при производстве полимеров.
Пищевая промышленность
- Каталитическое окисление применяется в пищевой промышленности для синтеза различных ароматических веществ и добавок.
- Оно позволяет получить продукты с заданными вкусовыми и запаховыми характеристиками.
- Также каталитическое окисление используется для очистки отходов и обеззараживания пищевых продуктов.
Все эти примеры свидетельствуют о широком применении каталитического окисления в промышленности. Этот процесс играет важную роль в различных отраслях, способствуя повышению эффективности производства и снижению негативного воздействия на окружающую среду.
Кислотный катализ.
Каталитическая активность большого класса катализаторов обусловливается их кислотными свойствами. Согласно И.Брёнстеду и Т.Лоури, кислота – это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г.Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованием ковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важные катализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя – Крафтса, такой, как HCl-AlCl 2 O 3 (или HAlCl 4), и алюмосиликаты. Сила кислоты – это очень важная характеристика, поскольку от нее зависит скорость протонирования – ключевого этапа процесса кислотного катализа.
Активность таких катализаторов, как алюмосиликаты, применяющихся при крекинге нефти, определяется присутствием на их поверхности кислот Брёнстеда и Льюиса. Их структура аналогична структуре кремнезема (диоксида кремния), в котором часть атомов Si 4+ замещена атомами Al 3+ . Лишний отрицательный заряд, возникающий при этом, может быть нейтрализован соответствующими катионами. Если катионами являются протоны, то алюмосиликат ведет себя как кислота Брёнстеда:
Активность кислотных катализаторов обусловливается их способностью реагировать с углеводородами с образованием в качестве промежуточного продукта карбений-иона. Алкилкарбений-ионы содержат положительно заряженный углеродный атом, связанный с тремя алкильными группами и/или атомами водорода. Они играют важную роль как промежуточные продукты, образующиеся во многих реакциях с участием органических соединений. Механизм действия кислотных катализаторов можно проиллюстрировать на примере реакции изомеризации н
-бутана в изобутан в присутствии HCl-AlCl 3 или Pt-Cl-Al 2 O 3 . Сначала малое количество олефина С 4 Н 8 присоединяет положительно заряженный ион водорода кислотного катализатора с образованием третичного карбений-иона. Затем отрицательно заряженный гидрид-ион Н – отщепляется от н
-бутана с образованием изобутана и вторичного бутилкарбений-иона. Последний в результате перегруппировки превращается в третичный карбений-ион. Эта цепочка может продолжаться с отщеплением гидрид-иона от следующей молекулы н
-бутана и т.д.:
Существенно, что третичные карбений-ионы более стабильны, чем первичные или вторичные. Вследствие этого на поверхности катализатора присутствуют в основном именно они, а потому основным продуктом изомеризации бутана является изобутан.
Кислотные катализаторы широко применяются при переработке нефти – крекинге, алкилировании, полимеризации и изомеризации углеводородов . Установлен механизм действия карбений-ионов, играющих роль катализаторов в этих процессах. При этом они участвуют в целом ряде реакций, включая образование малых молекул путем расщепления больших, соединение молекул (олефина с олефином или олефина с изопарафином), структурную перегруппировку путем изомеризации, образование парафинов и ароматических углеводородов путем переноса водорода.
Одно из последних применений кислотного катализа в промышленности – получение этилированных топлив присоединением спиртов к изобутилену или изоамилену. Добавление кислородсодержащих соединений в бензин уменьшает концентрацию оксида углерода в выхлопных газах. Метил-трет
-бутиловый эфир (МТБЭ) с октановым числом смешения 109 тоже позволяет получить высокооктановое топливо, необходимое для работы автомобильного двигателя с высокой степенью сжатия, не прибегая к введению в бензин тетраэтилсвинца. Организовано также производство топлив с октановыми числами 102 и 111.






























