Терминальный алкин
Изомеризация терминальных алкинов в аллены и далее в нетерминальные алкины относится к числу классических прототропных перегруппировок, включающих несколько последовательных стадии отщепления и переноса протона. Анионы, возникающие в результате депротонирования терминального алкина и аллена, представляют собой типичные мезомерные анионы, у которых заряд делокализован между С-1 и С-3 атомами углерода.
Кислотность терминальных алкинов можно объяснить тем, что в образовании связи С — Н участвует sp — гибридизованная орбиталь атома углерода ( разд. Связи С — Н в алкенах и алканах, образованные за счет sp2 — и р3 — орбиталей, менее склонны к ионизации, по крайней мере в Ю20 раз.
Мсталлирование терминальных алкинов может быть осуществлено нрн действии алюмогидридов щелочных металлов в присутствии пиридина или простого эфира.
Моногидроборирование терминальных алкинов катехолбораном приводит к соответствующим алкенилборным соединениям. При последующем бромировании получают алкенилбромиды с обра — щением конфигурации 5.2 — гибридизованного атома углерода, связанного с атомом бора.
Моногидроборирование терминальных алкинов катехолбораном приводит к соответствующим алкенилборным соединениям. При последующем бромировании получают алкенилбромиды с обращением конфигурации 5.2 — гибридизованного атома углерода, связанного с атомом бора. В то же время гидролиз с последующим иодированием образовавшегося алкенилдигидроксиборана дает алкенилиодиды, в которых конфигурация сохраняется ( см. гл.
Рассматривая реакцию алкилирования терминальных алкинов, следует отметить, что область ее применения ограничена.
При прямом карбоксилированни алкенилдиизобутнлаланов, образующихся при гидроалюминированни терминальных алкинов в углеводородных растворах, получают с умеренными выходами соответствующие алкеновые кислоты. Ат-комплексы получают путем прибавления к реакционной смеси 1 экв метил — или бутилли-гпя.
Алкины гидроэтерифицируются в мягких условиях и дают в. В случае терминальных алкинов присоединение сложноэфирной функциональной группы происходит часто по замещенному атому углерода ( по правилу Марковникова) с образованием разветвленных продуктов ; линейные сложные эфиры могут быть получены с высокой степенью селективности при использовании стабилизированных лигапдом катализаторов-на основе палладия и олова ( см. разд.
Все стадии прототропной перегруппировки обратимы, и положение равновесия при данной температуре определяется термодинамической стабильностью участвующих в нем изомеров. Алкины с неконцевой тройной связью стабильнее терминальных алкинов ( гл.
|
Общие методы синтеза циклоалканонов. |
Переходные металлы также были использованы для внутримолекулярной циклизации, например, в промотируемом никелем сочетании аллилдибромидов или в восстановительном сочетании дикетонов, однако их применение лишь в редких случаях дает преимущество по сравнению с обычными методами органического синтеза. В качестве примера можно привести окислительное сочетание терминальных алкинов в присутствии медных катализаторов ( реакция Зандмейера ), являющееся, вероятно, одной из наиболее известных органических реакций, катализируемых переходными металлами; эта реакция была использована для синтеза циклических соединений, содержащих в цикле до 54 атомов углерода.
Возможна и обратная изомеризация алкина с внутренней тройной связью в терминальный алкин. В основе одной из наиболее распространенных методик такой изомеризации лежит применение в качестве основания суспензии амида натрия в минеральном масле при 120 — 160 С. Алкины с неконцевой тройной связью под действием амида натрия в этих условиях быстро и практически необратимо превращаются в Na-соли терминальных алкинов. Натрийалкиниды нерастворимы в минеральном масле и выводятся поэтому из сферы реакции.
Реакции присоединения
Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
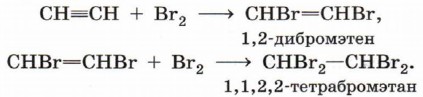
Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идёт в две стадии, причём на обеих стадиях выполняется правило Марковникова:
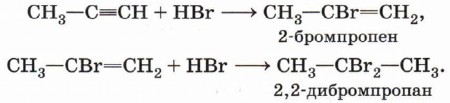
Рассмотрим, почему бромоводород присоединяется к алкинам в соответствии с правилом Марковникова.
Предпочтительное присоединение катиона водорода (электрофильной частицы) к более гидрированному атому углерода определяется большей устойчивостью катиона , стабилизированного положительным индуктивным эффектом метильной группы (см. § 9), по сравнению с карбокатионом , в котором донорное влияние метильнои группы на углерод с положительным зарядом ослаблено.
Чтобы определить направление присоединения второй молекулы бромоводорода, сравним устойчивость следующих карбокатионов:
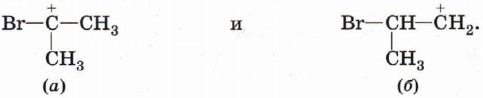
Частица (а) оказывается более устойчивой, так как она стабилизируется двумя положительными индуктивными эффектами метильных групп. Кроме того, атом брома обладает положительным мезомерным эффектом (орбиталь с неподелённой электронной парой брома перекрывается с незаполненной орбиталью атома углерода), который может проявиться только в том случае, если атом брома присоединён непосредственно к атому углерода, обладающему незаполненной орбиталью, т. е. несущему положительный заряд:
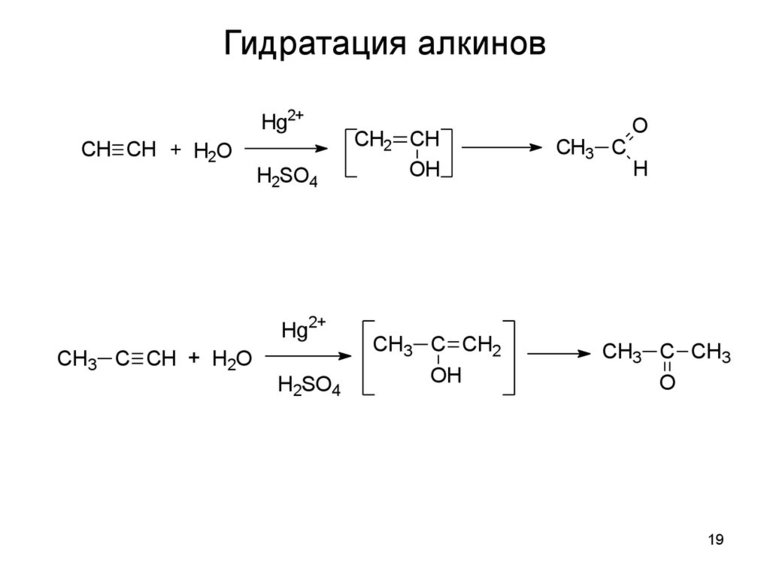
Гидратация (присоединение воды). Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
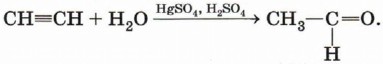
Вода присоединяется к ацетилену в присутствии солей ртути (II) в кислой среде с образованием непредельного спирта — енола:
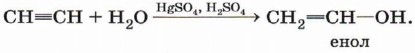
Получившийся енол немедленно превращается в альдегид:
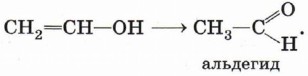
Явление взаимопревращения енолов и альдегидов (енолов и кетонов) называется кето-енольной таутомерией и будет более подробно рассмотрено в § 19 «Альдегиды и кетоны».
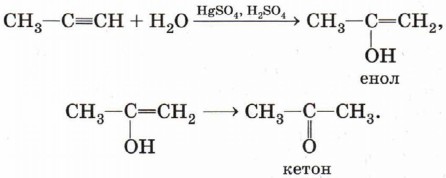
Альдегид образуется только при гидратации этина. В случае алкинов с более длинной цепью в соответствии с правилом Марковникова будет происходить образование енола с гидроксигруппой при менее гидрированном атоме углерода (водород присоединяется к крайнему атому углеродной цепи). Такие енолы превращаются в кетоны:
Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов (Pt, Pd, Ni):
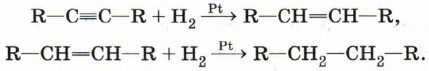
Так как тройная связь содержит две реакционноспособные π-связи, алкины присоединяют водород в две ступени.
Химическая структура
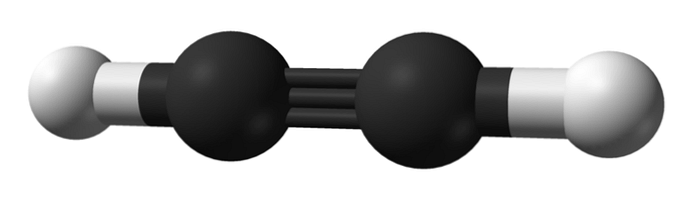
Какова структура алкинов? На верхнем изображении показана молекула ацетилена. Из него вы можете четко увидеть линейную геометрию C≡C-ссылки..
Поэтому там, где существует тройная связь, структура молекулы должна быть линейной. Это еще одно заметное различие между ними и остальными углеводородами..
Алканы обычно представлены в виде зигзагов, потому что они имеют sp-гибридизацию3 и его ссылки на 109º друг от друга. На самом деле они представляют собой цепочку тетраэдров, прикрепленных ковалентно. В то время как алкены являются плоскими путем sp-гибридизации2 его углерода, более конкретно, образуя треугольную плоскость со связями, разделенными на 120º.
У алкинов орбитальная гибридизация sp, то есть они имеют 50% характера s и 50% характера p. Есть две sp-гибридные орбитали, которые связаны с атомами H в ацетилене или с алкильными группами в алкинах.
Расстояние, разделяющее оба H или R, составляет 180º, кроме того, что только таким образом чистые p-орбитали углерода могут образовывать тройную связь. По этой причине ссылка -C≡C- является линейной. Видя структуру любой молекулы -C≡C- выделяется в тех областях, где скелет очень линейный.
Расстояние между ссылками и терминальной арендной платой
Углероды в тройной связи менее отдалены, чем в двойной или простой связи. Другими словами, C≡C короче, чем C = C и C-C. В результате этого связь становится сильнее, потому что две связи π способствуют стабилизации простой связи σ..
Если тройная связь находится в конце цепи, то это концевой алкин. Следовательно, формула указанного соединения должна быть HC≡CR, где H обозначает конец или начало цепи.
Если, с другой стороны, это внутренняя тройная ссылка, формула имеет вид RC≡CR ‘, где R и R’ — правая и левая сторона строки.
Получение ацетилена
Важнейший в практическом смысле алкин – ацетилен – может быть получен тремя способами:
-
Получение ацетилена из кокса — Реакция Вёллера (промышленный способ):
Ацетилен, полученный этим методом, обладает характерным запахом вследствие присутствия в нем следов сероводорода и фосфина, которые могут быть удалены при пропускании газа через раствор хлорной ртути в разбавленной соляной кислоте. Чистый ацетилен практически не имеет запаха.
-
Термическое разложение метана (промышленный способ). Процесс получения ацетилена при нефтехимическом синтезе включает частичное окисление углеводородов нефти с образованием в качестве побочных продуктов окиси углерода и водорода. При этом можно исходить как из метана, так и из высших углеводородов:
Технически данный способ реализуется либо сжиганием над специальной насадкой смеси природного газа с воздухом, в результате чего на этой насадке происходит пиролиз метана, либо пропусканием метана между двумя электродами с высокой скоростью.
-
Синтез Бертло:
Эта реакция эндотермичная ($\triangle H$ = 55 ккал) и, следовательно, требует большого количества энергии поэтому в настоящее время практически не используется и имеет лишь историческое значение в смысле получения органического соединения из неорганических веществ.
Статья: Получение алкинов
Найди решение своей задачи среди 1 000 000 ответов
реактивность
Реакционная способность алкинов объясняется добавлением малых молекул к их тройной связи, уменьшая их ненасыщенность. Это могут быть молекулы водорода, галогеноводороды, вода или галогены..
гидрирование
Малая молекула Н2 Это очень неуловимо и быстро, поэтому для повышения вероятности того, что они добавляются к тройной связи алкинов, необходимо прибегнуть к катализаторам.
Обычно это металлы (Pd, Pt, Rh или Ni), тонко разделенные для увеличения площади поверхности; и, таким образом, контакт между водородом и алкином:
RC≡CR ‘+ 2H2 => RCH2СН2R ‘
В результате водород «закрепляется» за атомами углерода путем разрыва связи и так далее, пока не будет получен соответствующий алкан, RCH2СН2R ‘. Это не только насыщает исходный углеводород, но и изменяет его молекулярную структуру.
Добавление галогеноводородов
Здесь добавляется неорганическая молекула HX, где X может быть любым из галогенов (F, Cl, Br или I):
RC≡CR ‘+ HX => RCH = CXR’
гидратация
Гидратация алкинов происходит, когда они добавляют молекулу воды с образованием альдегида или кетона:
RC≡CR ‘+ H2O => RCH2COR ‘
Если R ‘представляет собой Н, это альдегид; Если это алкил, то это кетон. В реакции в качестве промежуточного соединения образуется соединение, известное как енол (RCH = C (OH) R ‘)..
Этот переносит превращение енольной формы (C-OH) в кетоническую форму (C = O) в балансе, называемом таутомеризацией..
Добавление галогенов
Что касается дополнений, двухатомные молекулы галогенов также могут быть прикреплены к атомам углерода тройной связи (X2= F2, Cl2, бром2 или я2):
RC≡CR ‘+ 2X2 => RCX2-CX2R ‘
Алкилирование ацетилена
Другие алкины могут быть получены из раствора ацетилида натрия с использованием алкилгалогенида:
HC≡CNa + RX => HC≡CR + NaX
Например, если бы это был йодистый метил, то полученный алкин был бы:
HC≡CNa + CH3Я => HC≡CCH3 + NaX
HC≡CCH3 это совет, также известный как метилацетилен.
Получение алкинов
Метановый способ. Основным промышленным способом получения ацетилена является пиролиз метана и его ближайших гомологов. В качестве сырья используется природный газ. В 1868 г. французский химик М. Бертло получил ацетилен, пропуская через метан электрический разряд:
При температуре 1500 °С ацетилен является промежуточным продуктом разложения метана до углерода и водорода, поэтому основной технологический приём процесса заключается в быстром выводе ацетилена из сферы реакции и его охлаждении.
Одним из вариантов метанового метода синтеза ацетилена является окислительный пиролиз природного газа (рис. 22). Особенность этого метода состоит в том,
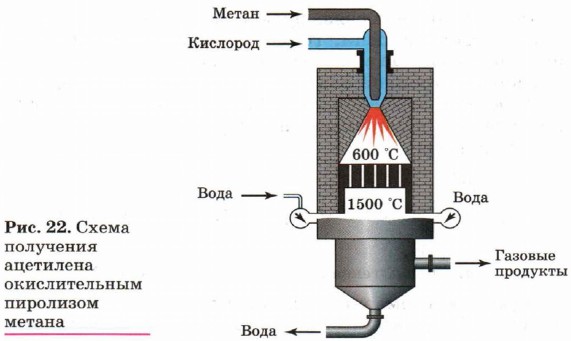
что в реактор вводится расчётное количество кислорода:
![]()
Помимо ацетилена в качестве продуктов реакции образуется оксид углерода (II) и водород, которые могут быть использованы для синтеза спиртов или синтетического бензина.
Карбидный способ. Давно известным и достаточно удобным способом получения этина является гидролиз (обменное взаимодействие веществ с водой) некоторых карбидов, например карбида кальция:
Карбид кальция получают взаимодействием оксида кальция, образовавшегося при обжиге (термическом разложении) карбоната кальция, с углем:
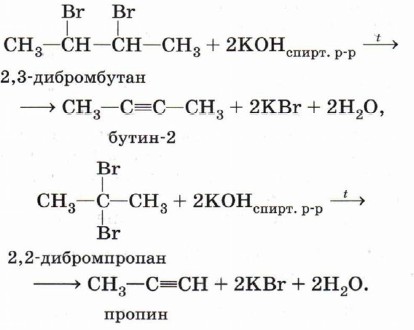
Дегидрогалогенирование. При воздействии на дибромпроизводное, в котором атомы галогенов находятся при соседних атомах углерода (или при одном и том же атоме), спиртового раствора щёлочи происходит отщепление двух молекул галогеноводорода (дегидрогалогенирование) и образование тройной связи:
Химические особенности
Алкины вступают в реакции с другими веществами лучше, чем алкены и алканы. Терминальные соединения, у которых тройная связь расположена в конце цепи, подвергаются замещениям. Водород с атомами углерода, гибридизированными в sp, могут проходить протонизацию, благодаря чему они и получают кислую природу.
Основным химические свойства алкинов:
- гидрирование;
- галогенирование;
- гидратация;
- присоединение меркаптанов, хлоридов, кислот и спирта;
- полимеризация;
- окисление.
При гидрировании активные катализаторы никель или платина восстанавливают алкины до состояния алканов, а процесс с гомологами ацетилена дает цис-олефины. Галогенирование происходит в два этапа, водород вступает в реакцию с хлором. Во время гидрогалогенирования на первом шаге образуется хлористый винилацетилен, на втором — дихлорэтан. Уравнение составляется по правилу Марковникова.
Гидратация образует ацетальдегид и кетоны из его гомологов, процесс протекает по реакции Кучерова. Спирты и меркаптаны присоединяются к водороду под воздействием едкого калия и монозамещенных ацетиленов. Для уксусной кислоты потребуется гетерогенный катализ, полученный винилацетат полимеризируется. К нему присоединяется синильное вещество, что образует акрилонитрил.
На тетрамеризацию влияют комплексные соли никеля, а для окисления нужно использовать раствор пергаманата калия и карбоновые кислоты. Качественный раствор становится розовым, но через несколько минут обесцвечивается. При соблюдении мягких условий окисления связи не разрываются. Продуктом реакции становится щавелевая кислота, но в нейтральной среде процесс можно остановить на стадии появления дикетонов. Если алкины горят, то они окисляются полностью до воды и углекислого газа. В результате экзотермической реакции выделяется много тепла.
Свойства алкинов
Физические свойства
По своим физическим свойствам алкины не сильно отличаются от алкенов и алканов. Например, простейший алкин, ацетилен, представляет собой газ без запаха и вкуса, мало растворимый в воде. Гомологи ацетилена включают как жидкие, так и твердые вещества: чем выше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Эти реакции протекают в две фазы:
Вопрос. Возможна ли реакция сложения для полученного соединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция сложения для полученного соединения? Почему?
Таким образом, и этилен, и этан могут быть получены из ацетилена с помощью реакции гидрирования. Все зависит от условий процесса и соотношения исходных материалов. Например, реакцию добавления хлористого водорода к ацетилену часто останавливают на первой стадии:
Причина в том, что хлорвинил используется для производства полимера полихлорвинила.
Задание 20.3: Составьте уравнения реакции полимеризации хлорвинила.
Продукты полихлорвинила (-CNCl-CH2–)nиспользуются различными способами.
Например, полихлорированный винил (ПХВ или ПВХ) является основой для искусственной кожи, различных одноразовых изделий, пластиковых контейнеров, футеровки, отделочных материалов и т.д. Многие пластиковые изделия, которыми мы пользуемся каждый день — обивка автомобилей, вагонов, самолетов — сделаны из ПВХ. Он также используется для изоляции кабелей.
Аналогичным образом происходят и другие реакции адгезии. Например, ацетилен, как и этилен, обесцвечивает бромированную воду. Он также обесцвечивает раствор перманганата калия, т.е. участвует в реакциях окисления.
Задание 20.4: Составьте уравнения для реакции ацетилена с бромом.
Таким образом, ацетилен также приводит к качественным реакциям в p-связи. Поэтому правильнее сказать, что реакции отбеливания воды бромом и перманганатом калия являются качественными реакциями по кратной связи. Другими словами, эти реакции могут быть использованы для обнаружения ненасыщенных соединений с кратной связью, содержащей p-связь.
Большое практическое значение имеет реакция добавления воды к ацетилену — гидратация ацетилена. Поскольку эта реакция была открыта и изучена русским ученым М.Г. Кучеровым*, ее называют «реакцией Кучерова»:
Ацетат альдегида используется для получения уксусной кислоты. Ожоги ацетиленом.
Задание 20.5: Напишите уравнение реакции горения ацетилена.
Газообразные углеводороды различают по типу пламени. Так, метан горит бесцветным пламенем, этилен — ярким пламенем, а ацетилен — дымным пламенем, т.е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В потоке кислорода ацетилен горит ослепительным синим пламенем и выделяет большое количество тепла (температура пламени составляет более 3000 °C!). По этой причине данная реакция используется при газовой сварке и резке металлов.
приложений
Ацетилен или этин
Наименьший из алкинов сгущает возможное число применений этих углеводородов. Из него посредством алкилирования могут быть синтезированы другие органические соединения. Кроме того, он подвергается окислительным реакциям для получения этанола, уксусной кислоты, акриловой кислоты и других..
Другое его использование состоит в обеспечении источника тепла для возбуждения электронов атомов; более конкретно катионов металлов в определениях методом поглощения-атомной эмиссии, широко используется спектроскопическая техника.
Натуральные алкино
Единственными существующими методами получения алкинов являются не только синтетические или с применением тепла в отсутствие кислорода, но и биологические.
В этих ферментах используются так называемые acetilenasas, который может дегидрировать двойную связь. Благодаря этому получается много природных источников алкинов.
В результате этого из этих источников могут быть извлечены яды, противоядия, лекарства или любое другое соединение, которое обеспечивает некоторую пользу; особенно когда это касается здоровья. Существует множество альтернатив при изменении их исходных структур, и они имеют поддержку новых алкинов..
Применение в органическом синтезе
Терминальные алкины активно используются в органическом синтезе для получения различных соединений. Один из основных методов — реакция алкини с другим компонентом, например, карбонильной группой в кетонах. Такой способ называется реакцией «клинка» и позволяет получить продукты с целым рядом функциональных групп.
Терминальные алкины также используются в реакциях, которые называются сокращением. В результате этой реакции, молекулы алкина объединяются, чтобы образовать новые, более сложные соединения.
Кроме того, терминальные алкины могут участвовать в реакциях ацетилирования, при которых они добавляются к ароматическим соединениям, образуя ацетилированный продукт.
Не менее важным применением терминальных алкинов являются реакции, такие как комбинация с любым из соединений с заместителями галогенов, что может приводить к образованию индивидуальных соединений, используемых в промышленности, как например, бензилхлорид.
Таким образом, терминальные алкины являются важными соединениями, используемыми в органическом синтезе благодаря их активности и возможности участвовать в различных реакциях, что делает их обязательным компонентом во многих химически сложных композициях.
Химические свойства терминальных алкинов
Терминальные алкины, также известные как кислородсодержащие алкины, представляют собой класс органических соединений, в которых углеродные атомы ацетиленового сегмента соединены как минимум с одной кислородной группой. Эти соединения обладают рядом уникальных химических свойств, которые делают их важными в органическом синтезе и промышленности.
1. Кислотные свойства: Терминальные алкины обладают кислотными свойствами и могут реагировать с основаниями, образуя соль и воду. Например, реакция ацетилена с натриевым гидроксидом приводит к образованию ацетилената натрия и воды.
2. Аддиционная реакция с галогенами: Терминальные алкины могут претерпевать аддиционные реакции с галогенами (например, хлор, бром) в условиях благотворной температуры и давления. При этом образуется галогенированный продукт. Например, ацетилен и хлор могут взаимодействовать, образуя 1,1,2,2-тетрахлорэтан.
3. Окисление: Терминальные алкины подвержены окислению в присутствии окислителей, например, кислорода или хлора, образуя соответствующие карбоновые кислоты. Например, ацетилен может окисляться до образования уксусной кислоты.
4. Дегидрирование: В условиях повышенной температуры и присутствия катализаторов терминальные алкины могут дегидрироваться, образуя соответствующие алкены. Например, ацетилен может дегидрироваться до образования этилена.
5. Полимеризация: Терминальные алкины могут полимеризоваться в присутствии катализаторов, образуя полимерные цепи. Например, ацетилен может полимеризоваться в полиэтилен.
6. Реакция с карбокатионами: Терминальные алкины могут реагировать с карбокатионами (положительно заряженные углеродные ионы), образуя соединения с карбонильной или карбоксильной группами. Например, ацетилен может реагировать с ацилхлоридами, образуя соответствующий карбонильный продукт.
Это лишь несколько примеров химических свойств терминальных алкинов. Их разнообразие и уникальные свойства делают их важными строительными блоками в органической химии и промышленном производстве.
Алкины в природе и медицине
По словам Фердинанда Больмана , первое встречающееся в природе ацетиленовое соединение, эфир дегидроматрикарии, было выделено из вида Artemisia в 1826 году. За прошедшие почти два столетия было обнаружено и зарегистрировано более тысячи встречающихся в природе ацетиленов. Полиины , подмножество этого класса натуральных продуктов, были выделены из множества видов растений, культур высших грибов, бактерий, морских губок и кораллов. Некоторые кислоты, такие как дегтярная кислота, содержат алкиновую группу. Diynes и triynes, виды со связью RC≡C – C≡CR ′ и RC≡C – C≡C – C≡CR ′ соответственно, встречаются у некоторых растений ( Ichthyothere , Chrysanthemum , Cicuta , Oenanthe и других представителей Asteraceae и Семейства Apiaceae ). Некоторые примеры — цикутоксин , энантотоксин и фалькаринол . Эти соединения обладают высокой биологической активностью, например, как нематоциды . 1-Фенилгепта-1,3,5-трин является иллюстрацией встречающегося в природе трина.
Алкины присутствуют в некоторых фармацевтических препаратах, в том числе в контрацептивном норетинодреле . Тройная углерод-углеродная связь также присутствует в имеющихся на рынке лекарствах, таких как антиретровирусный эфавиренц и противогрибковый тербинафин . Молекулы, называемые ен-диинами, имеют кольцо, содержащее алкен («ен») между двумя алкиновыми группами («дийн»). Эти соединения, например калихеамицин , являются одними из самых агрессивных известных противоопухолевых препаратов, настолько, что субъединицу ен-диина иногда называют «боеголовкой». Эне-диины подвергаются перегруппировке посредством циклизации Бергмана , образуя высокореактивные радикальные промежуточные соединения, которые атакуют ДНК внутри опухоли.
Источник
Реакции электрофильного присоединения
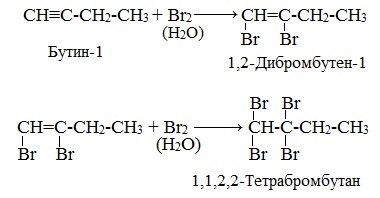
Галогенирование алкинов происходит в два этапа. Во время первой стадии электрофильного присоединения галогенов формируются дигалогеналкены. На втором этапе образуются тетрагалогеналканы. Схематично данные процессы представлены на рисунке.
Примечание
При реакции алкинов на бромную воду можно наблюдать качественную реакцию на алкины. В результате бромная вода теряет цвет.
Гидрогалогенирование происходит в соответствии с электрофильным механизмом. В процессе к алкинам присоединяются галогеноводороды. Реакция характеризуется двумя стадиями. Второй этап подчиняется правилу Марковникова. Присоединение НCl при отсутствии катализирующего компонента протекает с медленной скоростью. В качестве катализатора такой реакции используются кислоты Льюиса, то есть соли меди (I) и ртути (II).
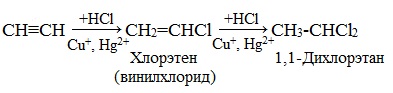
В результате химической реакции получается хлористый винил или винилхлорид. Вещество характеризуется легкостью полимеризации, аналогично этилену, после чего образуется полимер, называемый поливинилхлоридом. Вещество обладает широкими сферами применения для изготовления поливинилхлоридных смол.
Синтез и получение
Терминальные алкины могут быть получены различными способами, включая:
- Деактивация галогеналканов: один из наиболее распространенных способов получения терминальных алкинов, заключается в использовании галогеналканов, например хлорэтана или бромэтана. При этом галогениды обрабатываются сильными основаниями, например калиевым гидридом, что приводит к выделению терминальных алкинов.
- Сульфонирование: еще один способ получения терминальных алкинов, заключается в применении сульфокислот, например, паратолуенсульфоновой кислоты, к алкенам. После этого следует обработка полученной сульфонной кислоты сильным основанием, что приводит к выделению терминальных алкинов.
- Холодное щелочное гидролиз: этот способ заключается в обработке алкинов сильной щелочью на низких температурах. После взаимодействия с щелочью, алкины поверхностно окисляются, что приводит к выделению терминальных алкинов.
Необходимо помнить, что синтез терминальных алкинов со специальными свойствами может потребовать более сложных и долгих процессов в зависимости от их желаемых свойств и целевого применения.
| Способ получения | Преимущества | Недостатки |
|---|---|---|
| Деактивация галогеналканов | Простой и быстрый метод получения | Высокая токсичность галогеналканов, которые могут быть использованы |
| Сульфонирование | Экономичный метод для получения большого объема терминальных алкинов | Требуется тщательная очистка продукта для удаления всех сульфатных соединений |
| Холодное щелочное гидролиз | Не требуется использование дополнительных химических реагентов | Длительный процесс, неэффективен для большого объема продукта |
Физико-химические свойства алкинов
полярность
Тройная связь отличает алкины от алканов и алкенов. Три типа углеводородов неполярные, нерастворимые в воде и очень слабые кислоты. Однако электроотрицательность атомов углерода двойных и тройных связей больше, чем у простых атомов углерода..
В соответствии с этим, атомы углерода, соседствующие с тройной связью, придают ему индуктивную отрицательную плотность заряда. По этой причине, где имеются связи C≡C или C = C, электронная плотность будет выше, чем в остальной части углеродного скелета. Как следствие, существует небольшой дипольный момент, при котором молекулы взаимодействуют диполь-дипольными силами.
Эти взаимодействия очень слабые, если сравнить их дипольные моменты с молекулами воды или любого спирта. Это отражено в его физических свойствах: алкины обычно имеют более высокие температуры плавления и кипения по сравнению с их менее ненасыщенными углеводородами.
Также из-за их плохой полярности они менее нерастворимы в воде, но растворимы в неполярных органических растворителях, таких как бензол.
кислотность
Также эта электроотрицательность вызывает водород HC≡CR более кислый, чем любой другой углеводород. Следовательно, алкины являются более кислыми соединениями, чем алкены, и намного больше, чем алканы. Однако его кислотность все еще незначительна по сравнению с кислотностью карбоновых кислот..
Поскольку алкины являются очень слабыми кислотами, они реагируют только с очень сильными основаниями, такими как амид натрия:
HC≡CR + NaNH2 => HC≡CNa + NH3
Из этой реакции получают раствор ацетилида натрия, который является сырьем для синтеза других алкинов..






























