«Строение электронных оболочек атомов»
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Если N — максимальное число электронов на электронном слое с номером n, то для определения числа N можно воспользоваться формулой N = 2n2.
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)
Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
Электроны первых 30 химических элементов от водорода до цинка размещены на орбиталях трех видов — s, р и d. Вместимость любой орбитали — два электрона. На 1-м энергетическом уровне одна s-орбиталь.
Таблица. Строение электронных оболочек атомовпервых 20 элементов Периодической системы Д.И. Менделеева
Приведем некоторые сведения, которые следуют из электронной формулы атома на примере атома фтора: F 1s2 2s2 2р5.
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Конспект урока «Строение электронных оболочек атомов».
Вандерваальсовы силы
В 1873 г. Голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обуславливающие притяжение между молекулами. Эти силы позднее получили название вандерваальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперсионное взаимодействие.
При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя.
Диполи могут воздействовать на неполярные молекулы, превращая их в индицированные (наведенные) диполи.
В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается.
Презентация на тему: » Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется.» — Транскрипт:
1
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов. Сайт учителя биологии и химии

2
В качестве примера- взаимодействие атомов водорода и хлора CI 1 s 2 2s 2 2 р 6 3s 2 Зр 5 -семь электронов на внешнем уровне Н 1s 1 — один электрон Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку.
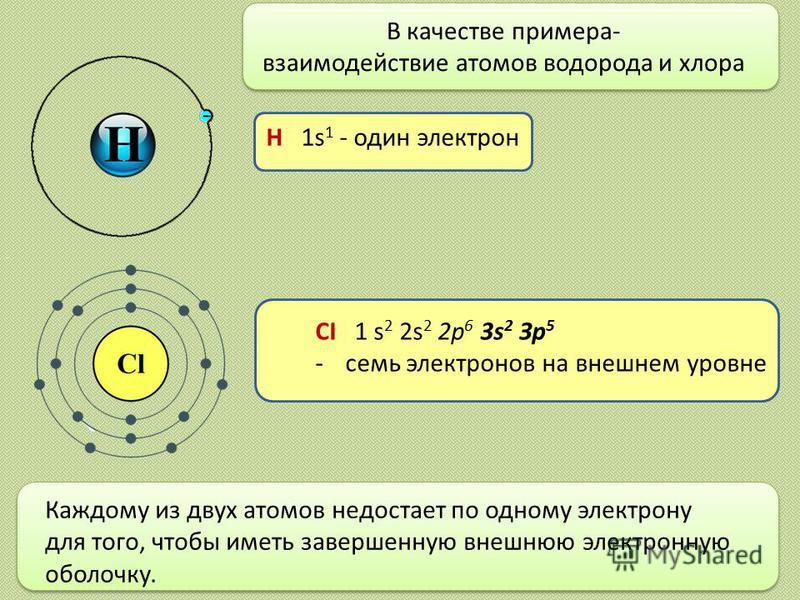
3
Лучше всего изображать это с помощью формул Льюиса: Каждый из атомов выделяет «в общее пользование» по одному электрону. Правило октета оказывается выполненным.
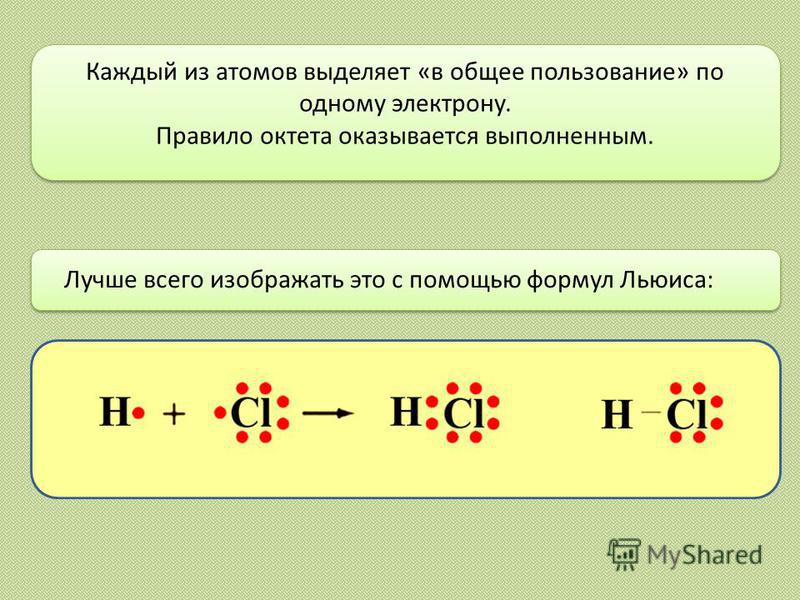
4
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора

5
Образовавшаяся при связывании двух атомов частица называется молекулой.

6
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода 0 2 или азота N 2.
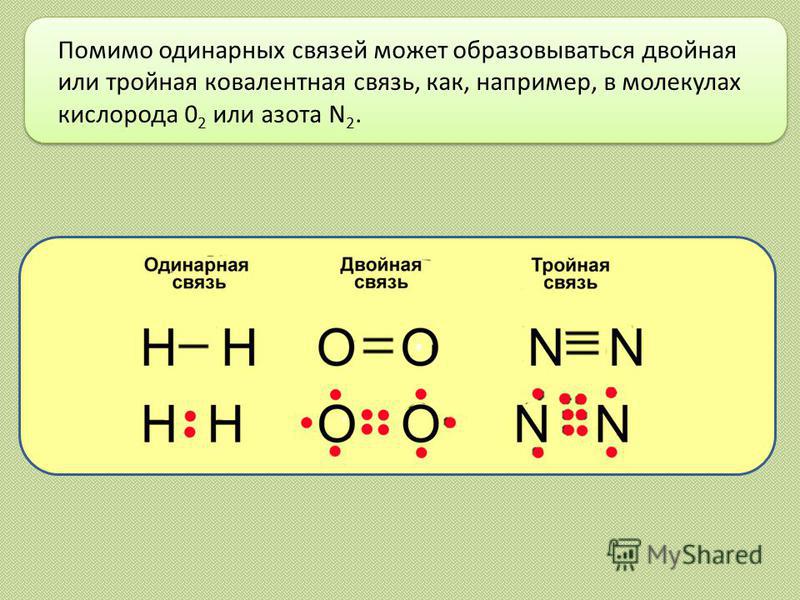
7
Одним из редких исключений является алмаз, который плавится выше °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Любой кристалл алмаза представляет собой одну огромную молекулу. Ковалентные соединения обычно газы, жидкости или сравнительно низкоплавкие твердые вещества
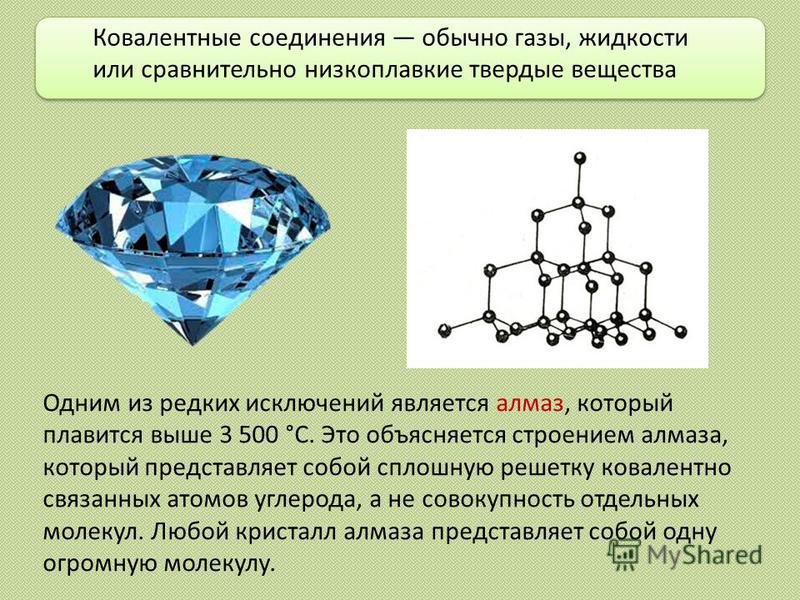
8
ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ КОВАЛЕНТНАЯ ДОНОРНО- АКЦЕПТОРНАЯ СВЯЗЬ

9
У каждого атома водорода имеется электрон. При сближении двух атомов возникает такой момент, когда оба электрона будут находиться рядом. Что получается? НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ У левого атома (зеленый) стало 2 электрона на орбитали очень выгодное энергетическое состояние, и у правого атома (синий) стало 2 электрона тоже выгодное состояние. Образуется молекула водорода. Образуется общая электронная пара
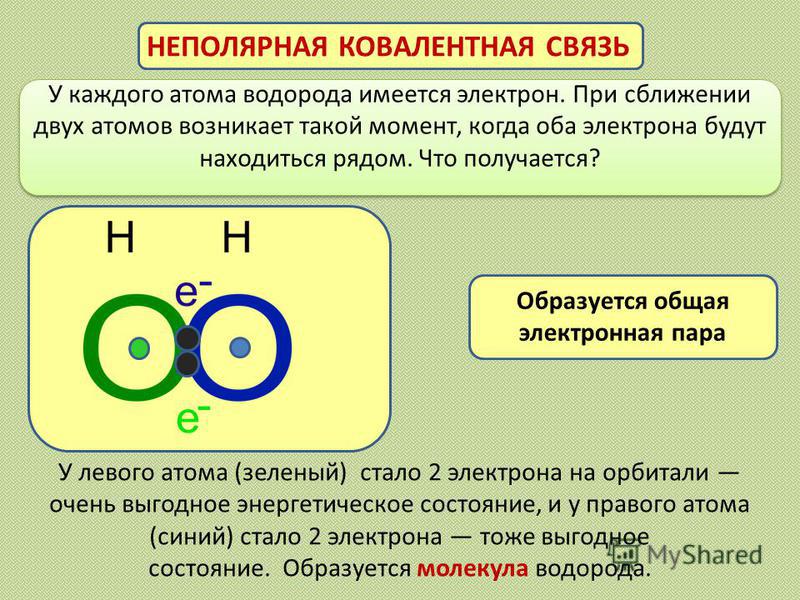
10
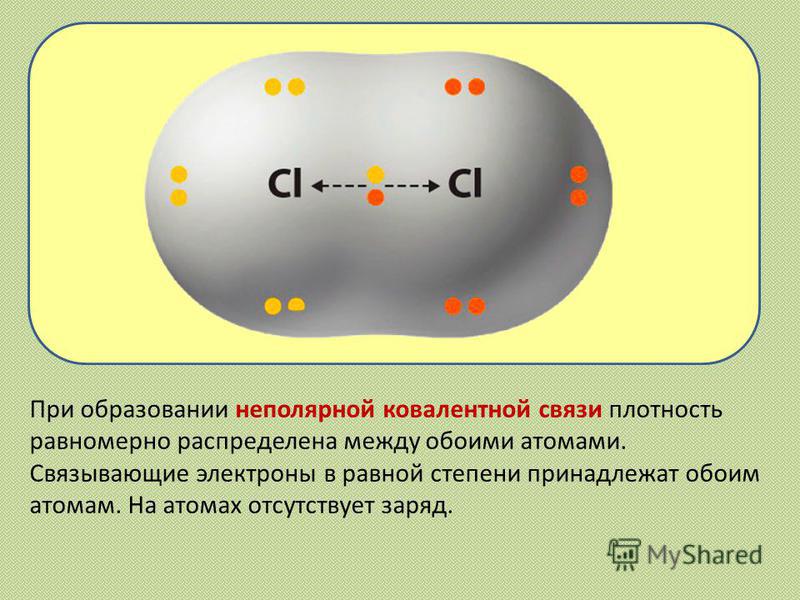
При образовании неполярной ковалентной связи плотность равномерно распределена между обоими атомами. Связывающие электроны в равной степени принадлежат обоим атомам. На атомах отсутствует заряд.
11
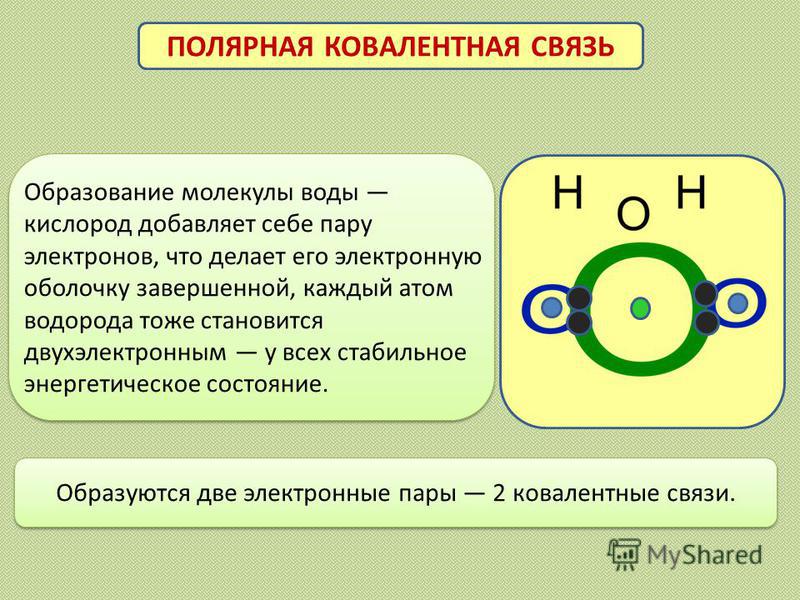
Образуются две электронные пары 2 ковалентные связи. ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ Образование молекулы воды кислород добавляет себе пару электронов, что делает его электронную оболочку завершенной, каждый атом водорода тоже становится двухэлектронным у всех стабильное энергетическое состояние.
12
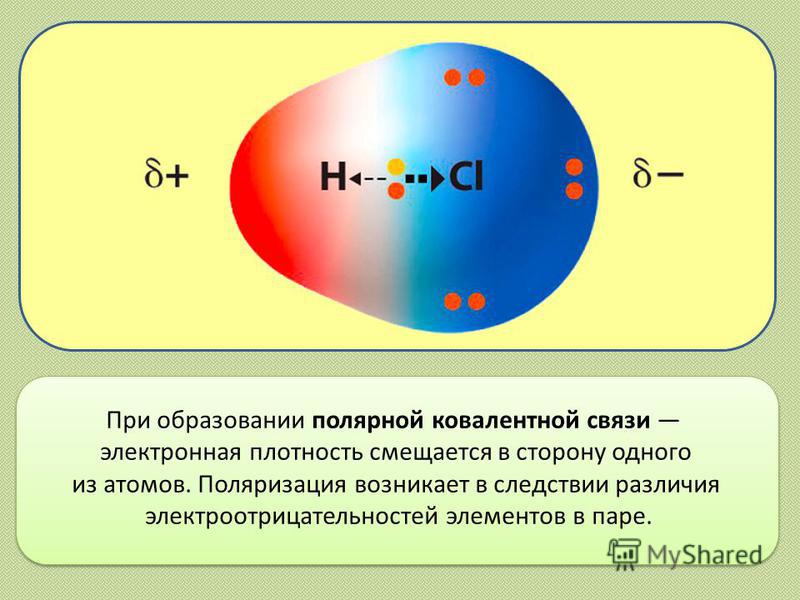
При образовании полярной ковалентной связи электронная плотность смещается в сторону одного из атомов. Поляризация возникает в следствии различия электроотрицательностей элементов в паре.
13
КОВАЛЕНТНАЯ ДОНОРНО- АКЦЕПТОРНАЯ СВЯЗЬ Донорно-акцепторный механизм способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора.

14
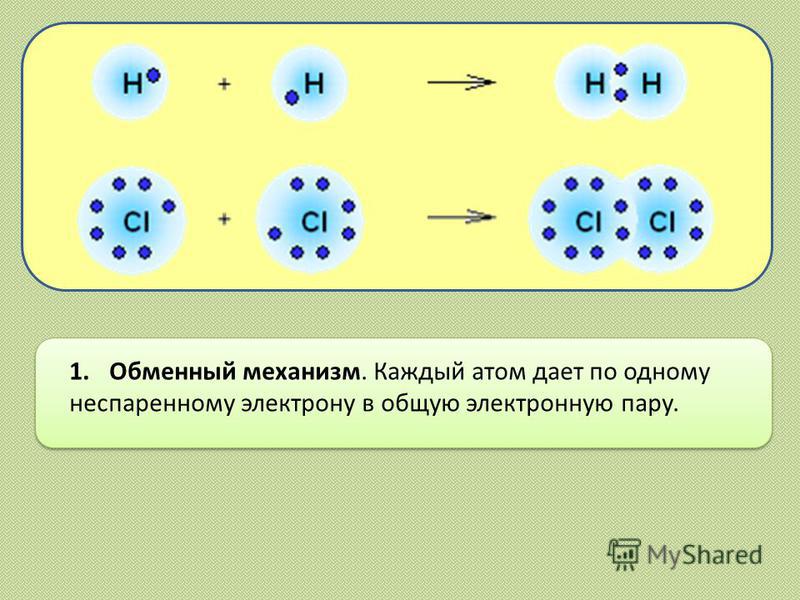
1. Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
15
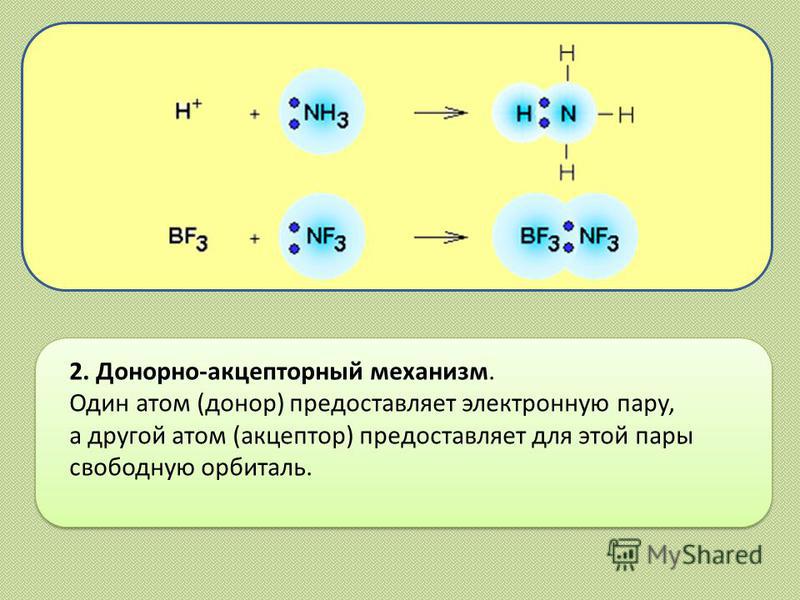
2. Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
16
Донорно-акцепторную ковалентную связь образуют атомы, имеющие неподеленную электронную пару доноры электронов (например, азот, кислород, фосфор, сера и т.д.) и атомы, образующие пустую орбиталь акцепторы (например, протон водорода и некоторые d- элементы). ИТОГ ПО ВИДАМ КОВАЛЕНТНОЙ СВЯЗИ: Ковалентную неполярную связь образуют одинаковые атомы неметаллов и атомы водорода; Ковалентную полярную химическую связь образуют разные атомы неметаллов и неметаллы с водородом;

Закон сохранения массы и энергии
Этот закон по существу был сформулирован М.В. Ломоносовым еще в 1760 г. Современная формулировка закона гласит: в изолированной системе сумма масс и энергий постоянна. Эта формулировка учитывает, что между массой m и энергией Е существует взаимосвязь согласно уравнению
где с — скорость света в пустоте, равная 3 108 м/с.
Это соотношение между энергией света и его массой обнаружил русский физик П.Н.Лебедев. Позднее А. Эйнштейн (1905) доказал, что уравнение справедливо для любых форм материи. Уравнение называется уравнением Эйнштейна..
Уравнение Эйнштейна указывает на взаимосвязь, а не на эквивалентность массы и энергии и не их превращения друг в друга.
Фермионные и бозонные обобществленные состояния
Фермионы подчиняются ферми-дираковской статистике, которая устанавливает, что нельзя иметь две одинаковые частицы с одним и тем же квантовым состоянием. Если электроны являются фермионами, они заполняют доступные квантовые состояния в пределе нулевой температуры вплоть до энергии Ферми. Это приводит к так называемому «принципу исключения Паули», который гласит, что каждое квантовое состояние может быть занято только одним электроном.
С другой стороны, бозоны следуют бозе-эйнштейновской статистике, в которой нет ограничений на количество частиц с одним и тем же квантовым состоянием. Если электроны обобществляются как бозоны, они могут находиться в одном и том же квантовом состоянии одновременно.
Для фермионов, включая электроны, обобществление происходит в виде «электронного газа». В этом случае, электроны заполняют уровни энергии от нижнего к верхнему, не превышая энергию Ферми.
Для бозонов, обобществление может привести к образованию так называемых «конденсатов Бозе-Эйнштейна». В этом состоянии все частицы находятся в одном и том же квантовом состоянии, что приводит к уникальным эффектам, таким как сверхпроводимость и сверхтекучесть.
Таким образом, процесс обобществления электронов может иметь различные характеристики в зависимости от их статистики, что приводит к разнообразным явлениям в физике конденсированного состояния вещества.
| Фермионы | Бозоны |
|---|---|
| Подчиняются ферми-дираковской статистике | Подчиняются бозе-эйнштейновской статистике |
| Принцип исключения Паули | Нет ограничений на количество частиц с одним состоянием |
| Образуют «электронный газ» | Могут образовывать «конденсаты Бозе-Эйнштейна» |
Как обобществленные электроны используются в научных исследованиях
Одним из основных методов исследования с использованием обобществленных электронов является электронная спектроскопия. Этот метод позволяет изучать свойства и структуру различных материалов на атомном уровне. С помощью спектроскопии можно определить химический состав образца, его электронную структуру и магнитные свойства. Благодаря этому исследователи могут более глубоко понять природу материалов и разрабатывать новые материалы с определенными свойствами.
Также обобществленные электроны используются в исследованиях в области поверхности материалов. С помощью техник, таких как сканирующая туннельная микроскопия (STM) и электронная микроскопия с полемионизацией (PEEM), исследователи могут изучать атомную и молекулярную структуру поверхности материалов и наноструктур. Это позволяет получить информацию о рельефе поверхности, размере и форме наночастиц, а также изучать взаимодействие между различными материалами на поверхности.
Кроме того, обобществленные электроны применяются в физике конденсированного состояния для изучения оптических и электронных свойств различных материалов. В частности, они используются в исследованиях полупроводников, металлов, магнетиков и других функциональных материалов. Это позволяет исследователям более полно понять механизмы транспорта зарядов в материалах и создать новые устройства с улучшенными электронными свойствами.
Таким образом, обобществленные электроны являются мощным инструментом для исследования различных свойств и структуры материалов на наноуровне. Они находят широкое применение в различных областях науки и способствуют развитию новых материалов и технологий.
Кто открыл, опыт Мандельштама и Папалекси
Первые опыты по изучению электрической проводимости металлов провел немецкий ученый Карл Виктор Эдуард Рикке в 1901 году. Суть эксперимента сводилась к следующему. Три отполированных цилиндра плотно прижали друг к другу, расположив в таком порядке: медь–алюминий–медь. В течение года через них пропускали ток в одном и том же направлении.
Суммарный заряд, прошедший через этот проводник за все время составил более 3,5 МКл. После завершения опыта цилиндры взвесили и выяснилось, что их массы не изменились. Это исследование стало доказательством того, что прохождение тока в металлах не связано с химическими процессами и переносом вещества, а заряд создается частицами, которые имеются у всех металлов, т.е. электронами.
Была собрана следующая установка: катушка на стержне со скользящими контактами, которые присоединены к гальванометру. Катушка вращалась с большой скоростью, затем резко останавливалась, при этом фиксировали отклонение стрелки гальванометра. В ходе эксперимента ученые установили, что электрон обладает массой. Но измерить эту массу они не смогли, опыт был только качественным.
Спустя три года физики Р. Толмен и Б. Стюарт предложили свой вариант подобного эксперимента, что позволило произвести количественные измерения. Им удалось вычислить массу электрона. Для этого они измерили заряд на выходах катушки, образующийся при торможении. После внезапной остановки катушки в цепи возникал импульс тока. Направление тока указывало на то, что он вызван движением отрицательных зарядов.
Применение обобществления электронов
Обобществление электронов находит широкое применение в различных областях науки и технологий. Управление и контроль за поведением электронов внутри группы или сети может быть использовано для решения различных задач.
Вот несколько примеров применения обобществления электронов:
- Электроника и микроэлектроника: Обобществление электронов применяется для создания различных электронных устройств и компонентов, таких как транзисторы, сенсоры, микросхемы и др. Введение обобществления электронов позволяет управлять их поведением, что является основой для работы электронных систем.
- Компьютерная и программная инженерия: Обобществление электронов использовано для создания параллельных вычислительных систем и алгоритмов с распределенной обработкой. Это позволяет решать сложные задачи более быстро и эффективно, сокращая время выполнения и улучшая производительность.
- Облачные вычисления и сетевые технологии: Обобществление электронов применяется для организации облачных вычислений и создания распределенных сетей. Обобществление позволяет эффективно управлять ресурсами и обрабатывать большие объемы данных, обеспечивая высокую отказоустойчивость и масштабируемость систем.
- Искусственный интеллект и машинное обучение: Обобществление электронов используется в разработке алгоритмов машинного обучения и искусственного интеллекта. Обобществление позволяет объединять знания и опыт отдельных электронов, что приводит к созданию сложных моделей и более эффективным решениям.
- Физика и нанотехнологии: В области физики обобществление электронов используется для изучения квантовых явлений и свойств наноматериалов. Обобществление позволяет исследовать и контролировать поведение электронов на микроскопическом уровне, что является основой для разработки новых материалов и устройств.
Таким образом, обобществление электронов играет важную роль в современной науке и технологиях, способствуя развитию новых решений и улучшению существующих систем и устройств.
Перспективы применения обобществления электронов в технологиях
Применение обобществления электронов может привести к созданию совершенно новых материалов с уникальными свойствами. Например, путем контролируемого обобществления электронов можно создавать материалы с экстремальной проводимостью или суперпроводимости, что может открыть новые возможности в электронике и энергетике.
В области электроники обобществление электронов может привести к созданию более эффективных электронных устройств и микрочипов. Обобществление электронов позволит увеличить плотность компонентов на микрочипе, что приведет к увеличению производительности и снижению размеров электронных устройств. Также, обобществление электронов может помочь в создании новых методов вычислений, таких как квантовые компьютеры.
Не менее важно применение обобществления электронов в научных исследованиях. Обобществление электронов позволит ученым получать более точные результаты исследований, так как совместное поведение электронов может привести к появлению новых физических явлений и эффектов
Это значительно расширит наши знания о мире и поможет в разработке новых технологий.
В заключение, обобществление электронов – это не только фундаментальное явление в физике, но и ключевая концепция для прогресса в различных технологиях. Применение обобществления электронов может привести к созданию новых материалов, развитию электроники и научных исследований. Это открывает перед нами широкие перспективы для развития технологий в будущем.
Ковалентная связь
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью.
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга. Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. Однако, при очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи) при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.
Особенности ковалентной химической связи являются ее направленность и насыщаемость. Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определенным направлениям, что и обуславливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах.
Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи.
Если ковалентная связь образована одинаковыми атомами, например Н-Н, О=О, Cl-Cl, N=N, то обобществленные электроны равномерно распределены между ними.
Такая связь называется ковалентной неполярной связью. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Критерием способности атома притягивают электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещения электронной пары в сторону ядра данного атома. Поэтому разность электроотрицательностти атомов характеризуется полярность связи.
Если же молекула образована различными атомами, то молекулярное электронное облако смещается в сторону наиболее электроотрицательного атома. Такая ковалентная связь называется полярной ковалентной связью.
Цели и принципы обобществления
Цель обобществления – создание и развитие инфраструктуры, которая позволяет электронам вступать во взаимодействие друг с другом и образовывать коллективное поведение. Это позволяет повысить эффективность работы и раскрыть потенциал электронов.
Принципы обобществления:
- Коллективность: обобществление предполагает сотрудничество и взаимодействие электронов внутри общей среды. Они объединяются в группы и коммуницируют друг с другом для достижения общих целей.
- Открытость: обобществление стремится к принятию новых электронов и интеграции их в существующую среду. Это создает условия для обмена знаниями, опытом и идеями.
- Взаимодействие: обобществление основано на взаимодействии между электронами и другими системами. Они могут обмениваться информацией, ресурсами и влиять друг на друга.
- Самоорганизация: обобществление способно самоорганизовываться, адаптироваться к изменяющимся условиям и принимать решения в интересах общего блага.
- Распределенность: обобществление может существовать в разных местах и пространствах, включая виртуальную среду. Нет ограничений на географическую локацию.
Принципы обобществления позволяют электронам эффективно работать вместе, обмениваться информацией и ресурсами, а также развиваться и приспосабливаться к изменяющимся условиям окружающей среды.
Проводимость металлов: электронный газ
Кристаллическая решетка металла создает внутренние силы, способствующие тому, чтобы электроны с внешних оболочек покидали «свое» ядро. Для их перехода в свободное состояние, переход в зону проводимости, не требуется дополнительных усилий.
Если к металлическому предмету приложить электрическое поле – потечет ток. Электрический ток – это суммарный электрический заряд, проходящий через сечение проводящего тела за секунду.
Электроны приходят в движение по всей длине проводника, измеренные значения тока одинаковы в любом сечении.
Отметим, что ток мгновенно возникает во всем проводнике благодаря распространению электрического поля, но свободные носители заряда, электроны, продвигаются весьма медленно.
При малых напряжениях они еле бредут, наталкиваясь на ядра атомов, их тепловое движение гораздо интенсивнее, чем упорядоченное перемещение к положительному электроду.
Если металл нагревать, ток уменьшится. Это оттого что тепловое движение самих электронов и кристаллической решетки замедляет упорядоченное движение электронов, иными словами, при повышении температуры электрическое сопротивление металл увеличивается, а его проводимость уменьшается.
Электрический ток повышает температуру металла, с этим связан первоначальный скачок тока в проводнике и последующее его снижение. Холодный металл имеет небольшое сопротивление и пропускает значительный ток; но этот ток нагревает металл, сопротивление растет, ток уменьшается.
Полупроводники.
Рис. 3
От диэлектрика полупроводник отличается только тем, что ширина Δ запрещенной зоны, отделяющей валентную зону от зоны проводимости, у него много меньше (в десятки раз). При T = 0 валентная зона в полупроводнике, как и в диэлектрике, целиком заполнена, и ток по образцу течь не может. Но благодаря тому, что энергия Δ невелика, уже при незначительном повышении температуры часть электронов может перейти в зону проводимости (рис. 3). Тогда электрический ток в веществе станет возможным, причем сразу по двум «каналам».
Во-первых, в зоне проводимости электроны, приобретая энергию в электрическом поле, переходят на более высокие энергетические уровни. Во-вторых, вклад в электрический ток дают… пустые уровни, оставленные в валентной зоне электронами, ушедшими в зону проводимости. Действительно, принцип Паули разрешает любому электрону занять освободившийся уровень в валентной зоне. Но, заняв этот уровень, он оставляет свободным свой собственный уровень и т. д. Если следить не за движением электронов по уровням в валентной зоне, а за движением самих пустых уровней, то оказывается, что эти уровни, имеющие научное название дырки, тоже становятся носителями тока. Число дырок, очевидно, равно числу электронов, ушедших в зону проводимости (так называемых электронов проводимости), но дырки обладают положительным зарядом, потому что дырка — это отсутствующий электрон.
Таким образом, в полупроводнике электрический ток — это ток электронов в зоне проводимости и дырок в валентной зоне. Такая проводимость полупроводника называется собственной.
Электроны и дырки при движении по кристаллу взаимодействуют с атомами кристаллической решетки, теряя при этом свою энергию. С этими потерями связано электрическое сопротивление вещества. При увеличении температуры потери энергии возрастают, так что сопротивление полупроводника должно было бы с ростом температуры тоже увеличиваться. Но при повышении температуры растет число электронов, переходящих в зону проводимости, а следовательно, и число дырок r валентной зоне. Это значит, что растет (и очень быстро) общее число носителей тока. Из-за этого сопротивление полупроводника с повышением температуры не растет, а падает. Полупроводник и можно определить как вещество, практически не проводящее ток при абсолютном нуле температур, но сопротивление которого с ростом температуры резко падает.
В природе, однако, полупроводников с собственной проводимостью не существует: в них всегда имеются примеси других веществ, которые и определяют их электрические свойства. Наличие примесей приводит к тому, что в запрещенной зоне полупроводника появляются дополнительные энергетические уровни, с которых или на которые тоже возможны электронные переходы. Широкое применение полупроводников в технике стало возможным только после того, как технологи научились управлять содержанием примесей в полупроводниках и по своему усмотрению делать их проводимость (примесную проводимость) почти чисто электронной или чисто дырочной.
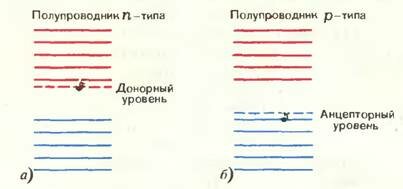
Рис. 4
Оказывается, можно подобрать такие примеси, атомы которых легко отдают электроны. Освободившиеся при этом дополнительные уровни энергии располагаются внутри запрещенной зоны полупроводника вблизи ее верхнего края (рис. 4, а). Такие примеси называются донорными примесями, а уровни — донорными уровнями. Из рисунка 4, а видно, что при одной и той же температуре электронам с таких уровней гораздо легче перейти в зону проводимости, чем электронам из валентной зоны, поэтому примесные уровни и станут основными поставщиками электронов в зону проводимости. Но при этом в валентной зоне дырок появляться не будет, и проводимость полупроводника станет почти чисто электронной. Такие полупроводники называются полупроводниками n-типа.
Существуют и такие примеси, атомы которых легко присоединяют к себе электроны (акцепторные примеси). Дополнительные уровни их электронов (акцепторные уровни) тоже располагаются внутри запрещенной зоны полупроводника, но вблизи ее дна (рис. 4, б). В этом случае электронам из валентной зоны легче перейти на акцепторные уровни примеси, чем в зону проводимости. Тогда в валентной зоне появятся дырки без того, чтобы в зоне проводимости появились электроны. Получится полупроводник с почти чисто дырочной проводимостью, или полупроводник p-типа.
Наиболее известные полупроводниковые материалы — это германий и кремний, а их главные технические применения как раз и связаны с возможностью создания образцов n- и p-типов («Физика 9», с. 212).






























