Примеры решения задач
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: иодоводорода HI и оксида азота (I). |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа. |
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов.
Ответ Плотности иодоводорода по воздуху, кислороду и азоту соответственно равны 4,41, 4 и 4,57; плотности оксида азота (I) по воздуху, кислороду и азоту соответственно равны 1,52, 1,375 и 1,57.
| Задание | Вычислите плотность а) по кислороду; б) по азоту; в) по воздуху следующих газов: оксида азота (IV) и фтороводородаHF. |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа. |
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов.
Ответ Плотности фтороводорода по воздуху, кислороду и азоту соответственно равны 0,69, 0,625 и 0,71; плотности оксида азота (IV) по воздуху, кислороду и азоту соответственно равны 1,59, 1,44 и 1,64.
Копирование материалов с сайта возможно только с разрешения администрации портала и при наличие активной ссылки на источник.
Практическое применение относительной плотности азота
Относительная плотность азота по воздуху играет важную роль в различных промышленных и научных областях. Рассмотрим несколько практических применений этого параметра.
1. Производство жидкого азота.
Относительная плотность азота позволяет определить, какое количество жидкого азота можно получить из определенного объема газообразного азота при заданных условиях
Это крайне важно для индустрии, где жидкий азот широко применяется в криогенной технике, производстве пищевых продуктов и других отраслях
2. Газоанализ.
Относительная плотность азота также используется при проведении газоанализа, например, при измерении концентрации азота в воздухе или других газовых смесях. Некоторые газоаналитические приборы определяют концентрацию азота исходя из его относительной плотности.
3. Топливные системы.
В авиации и автомобильной индустрии относительная плотность азота имеет значение при разработке и использовании топливных систем. Зная относительную плотность азота, можно определить его влияние на работу топливного оборудования и эффективность сгорания топлива.
4. Пищевая промышленность.
В производстве пищевых продуктов азот активно используется для упаковки и консервации. Относительная плотность азота позволяет определить его концентрацию в газовой среде для обеспечения правильной консистенции и качества продуктов.
Таким образом, знание относительной плотности азота и его практическое применение позволяют эффективно решать задачи в различных областях, включая производство, науку и промышленность.
Краткое описание химических свойств и плотность азота
Молекулярный азот обладает крайне низкой реакционной способностью, что обусловлено наличием в молекуле N2 прочной тройной связи, а также неполярностью молекулы. Действительно, энергия ионизации молекулы азота 1402 кДж/моль близка к энергии ионизации атома аргона 1520 кДж/моль, иными словами, азот – плохой восстановитель.
Сродство молекулярного азота к электрону -3,6 эВ, поэтому при комнатной температуре он реагирует лишь с некоторыми сильными восстановителями, например, с литием. Процесс протекает через стадию одноэлектронного восстановления с образованием неустойчивого пернитрида Li + N2 — , который в ходе реакции превращается в нитрид:
Для образования нитрида магния Mg3N2 из простых веществ требуется нагревание до 300 o С. Нитриды активных металлов представляют собой ионные соединения, гидролизующиеся водой с образованием аммиака.
В электрическом разряде в молекуле азота происходит переход электрона с орбитали σ(2pz) на π * (2pz). Такие возбужденные молекулы быстро возвращаются в обычное состояние, испуская желтое свечение. Иногда оно длится в течение нескольких минут после прекращения разряда. В возбужденном состоянии азот обладает высокой реакционной способностью. Действительно, в электрическом разряде он реагирует с кислородом:
Реакция с водородом протекает при повышенных значениях температуры (400 o С) и давления (200 атм) в присутствии катализатора (Fe):
Азот не взаимодействует с серой и галогенами.
Измерение относительной плотности по азоту: методы и приборы
Существует несколько методов для измерения RP, каждый из которых требует использования специального оборудования и приборов. Один из наиболее распространенных методов — метод гидростатического взвешивания.
При использовании метода гидростатического взвешивания необходимо использовать плотнометр, который представляет собой стеклянную трубку с градуировкой и пловцом, который плавает в жидкости. Появление пловца на определенной отметке указывает на достижение определенной плотности. Определяется относительная плотность путем измерения уровня погружения пловца в нефтепродукт и сравнения полученных данных с эталонными значениями.
Другой метод измерения RP — метод пеныкомпенсации. При использовании этого метода, прибор, известный как пеныкомпенсатор, используется для измерения относительной плотности нефтепродукта. Пеныкомпенсатор создает искусственную пену в нефти, которая увеличивает ее объем. Затем измеряется объем и масса полученной пены, что позволяет определить плотность нефтепродукта.
Некоторые другие методы для измерения RP включают использование газометрических приборов и использование специализированных анализаторов. Все эти методы имеют свои преимущества и ограничения, и выбор метода зависит от конкретных требований и условий измерения.
| Метод | Описание |
|---|---|
| Гидростатическое взвешивание | Измерение уровня погружения пловца в нефти для определения относительной плотности. |
| Метод пеныкомпенсации | Использование пеныкомпенсатора для создания искусственной пены и измерения ее объема и массы. |
| Газометрические приборы | Использование специальных приборов для измерения количества газа, который служит показателем плотности нефтепродукта. |
| Специализированные анализаторы | Использование анализаторов, способных измерять плотность и состав нефтепродукта. |
Измерение относительной плотности по азоту в нефтепродуктах является важным этапом во многих процессах, связанных с нефтегазовой промышленностью. Точное измерение плотности позволяет определить качество нефтепродуктов, контролировать процессы производства и обеспечить соответствие требованиям стандартов и нормативных актов.
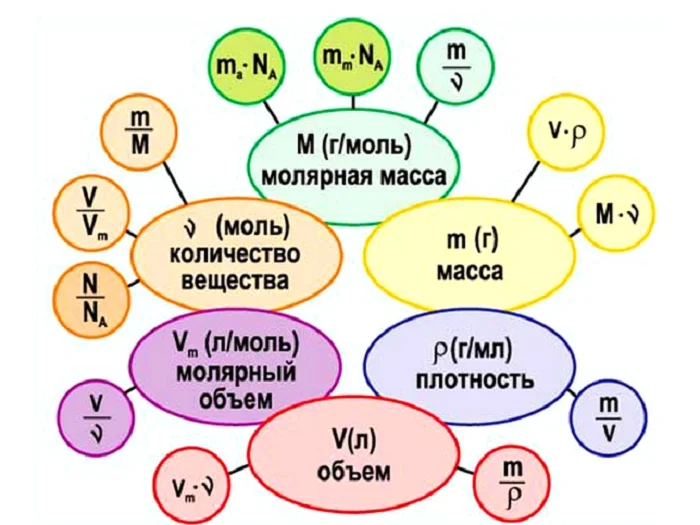
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
 (Источник)
(Источник)
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
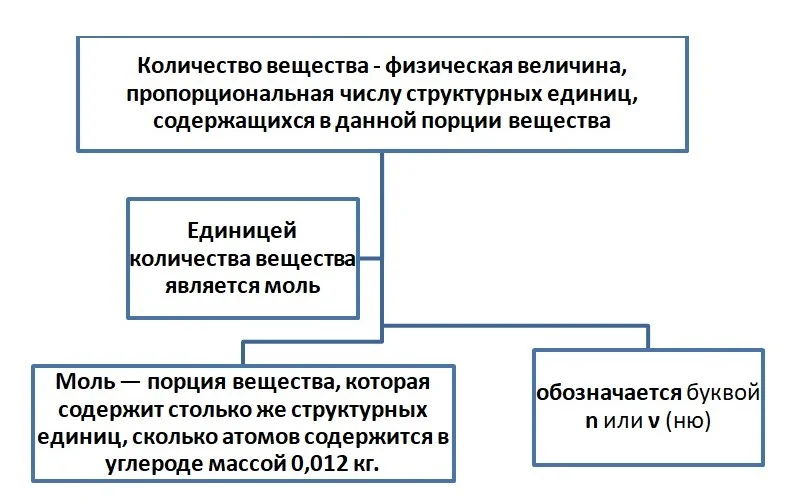
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10−23г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
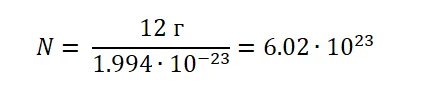
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙1023 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
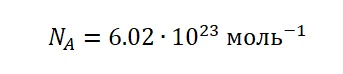
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
N = n * NA
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N — количество структурных единиц,
n — количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 1024 молекул хлора? 
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г/моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
m = n * M
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.

С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 1023 структурных единиц.
(Источник)
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
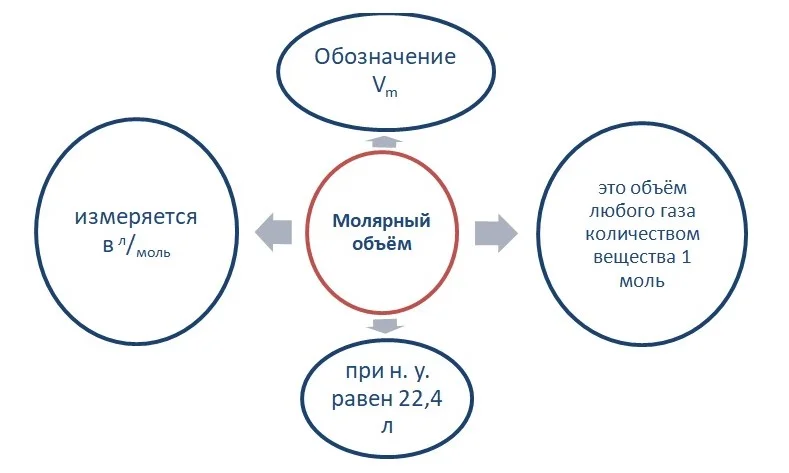
Связь количества вещества и объёма выражается в следующем виде:
V = n * Vm
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?

Как можно увидеть, количество вещества связывает три величины:

Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
 (Источник)
(Источник)
Химическая формула
Химия — уникальная наука, которая обладает своим языком и «алфавитом». Каждый химический элемент имеет своё название и собственный «адрес» в периодической системе.
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
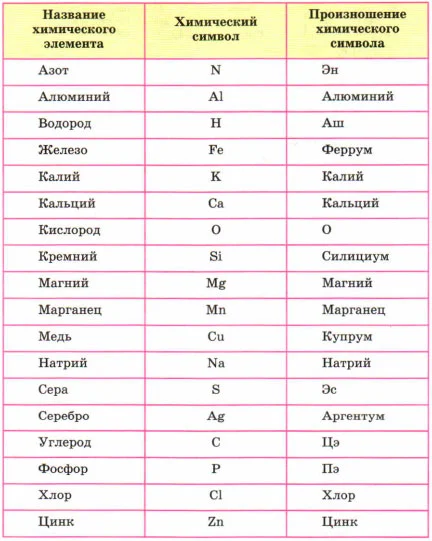
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.

H2SO4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H2SO4 – красным выделены знаки элементов, они указывают качественный состав.
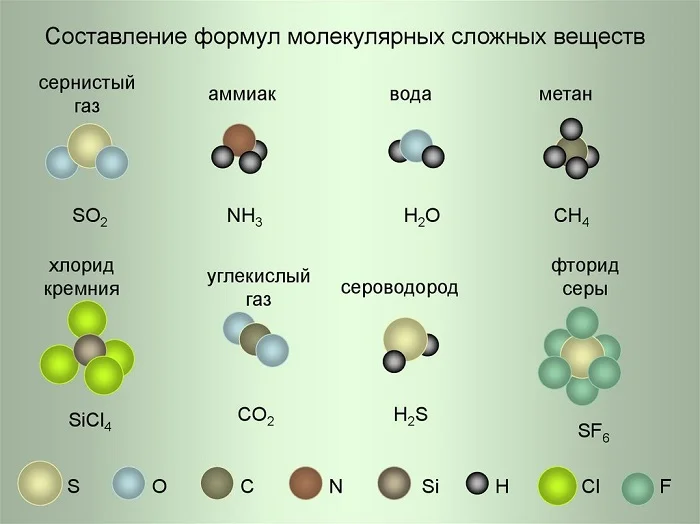
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
 (Источник)
(Источник)
- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Как измеряется относительная плотность азота
Измерение относительной плотности азота может быть проведено с использованием различных методов. Один из распространенных методов — это использование гравиметрического анализа. В этом методе измеряется масса заданного объема азота и воздуха при стандартных условиях и затем сравнивается их плотность.
Другой метод измерения — это использование пикнометрии. Пикнометр, закрытый сосуд с известным объемом, заполняется азотом и воздухом при стандартных условиях, а затем измеряется масса заполненного пикнометра. Зная объем пикнометра и массу заполненного пикнометра, можно вычислить относительную плотность азота.
Относительная плотность азота также может быть измерена с использованием плотномеров или плотиметров, которые определяют плотность жидкостей и газов. Эти устройства используются для вычисления плотности азота путем сравнения его с известной плотностью других веществ.
Необходимо отметить, что точность измерения относительной плотности азота зависит от использованных методов и оборудования
Поэтому важно использовать достоверные и проверенные методы, чтобы получить надежные результаты
Примеры из реальной жизни
Относительная плотность имеет много применений в различных областях жизни, включая химию, физику, строительство и другие отрасли. Вот несколько примеров, где относительная плотность играет важную роль:
-
В горнодобывающей промышленности:
Относительная плотность используется для определения содержания ценных металлов в руде. Высокая относительная плотность указывает на большое содержание металла в руде и может быть одним из критериев для принятия решения о дальнейшей переработке руды.
-
В процессах разделения смесей:
В различных процессах химической и биологической очистки используется относительная плотность для разделения компонентов смесей. Например, при фильтрации или центрифугировании, вещества с разной плотностью могут быть разделены на основе разности их относительных плотностей.
-
В строительстве и гражданском инженерном деле:
Относительная плотность используется для оценки прочности материалов и конструкций. Например, при разработке фундаментов зданий или мостов, необходимо учитывать относительную плотность грунта, чтобы обеспечить надежную конструкцию.
-
В продуктах питания:
Относительная плотность может быть использована для оценки качества и состава продуктов питания. Например, при изготовлении сыра, относительная плотность может быть использована для определения содержания молочного жира и влаги в сырной массе.
-
В плавательных средствах:
Относительная плотность играет важную роль при определении плавучести различных плавательных средств. Например, при проектировании лодок, разница в относительной плотности между корпусом и водой определяет, насколько судно будет плавать на поверхности или погружаться в воду.
Влияние на свойства вещества
Относительная плотность вещества является одним из основных показателей его свойств.
Вещество с большей относительной плотностью обычно более плотное, тяжелое и компактное. Такое вещество обладает большей массой при одинаковом объеме по сравнению с веществом с меньшей относительной плотностью.
Относительная плотность также может указывать на прочность вещества. Обычно материалы с большей относительной плотностью также обладают большей прочностью и устойчивостью к деформациям.
Однако, относительная плотность не является единственным показателем, определяющим свойства вещества. Она может варьироваться в зависимости от условий окружающей среды, температуры и давления.
Например, вода имеет относительную плотность 1 при 4 °C, что делает ее удобной для использования в качестве стандарта для измерения относительной плотности других веществ. Относительная плотность воды также изменяется с изменением температуры и солености воды.
Изменение относительной плотности может влиять на такие свойства вещества, как плавучесть и растворимость. Вещество с меньшей относительной плотностью, чем жидкость, в которую оно погружено, будет плавать на поверхности жидкости. Вещество с большей относительной плотностью будет тонуть.
Также относительная плотность может влиять на растворимость вещества в других веществах. Обычно вещества с более близкими относительными плотностями легче смешиваются и растворяются друг в друге. Материалы с большим различием в относительной плотности могут быть несовместимыми и не смешиваться.
| Свойство | Влияние относительной плотности |
|---|---|
| Плотность | Чем больше относительная плотность, тем плотнее вещество. |
| Прочность | Материалы с большей относительной плотностью чаще обладают большей прочностью. |
| Плавучесть | Вещество с меньшей относительной плотностью будет плавать на поверхности жидкости с большей плотностью. |
| Растворимость | Вещества с более близкими относительными плотностями легче смешиваются и растворяются друг в друге. |
Изменение относительной плотности азота с температурой
При низких температурах азот находится в жидком состоянии и его плотность значительно выше, чем при комнатной температуре или выше. По мере нагревания азот переходит в газообразное состояние, и его плотность снижается.
Температурная зависимость относительной плотности азота описывается уравнением:
ρ(T) = ρ(0) * (1 — β * T)
Где:
- ρ(T) — относительная плотность азота при температуре Т;
- ρ(0) — относительная плотность азота при температуре 0°C (равна 1.2506);
- β — коэффициент зависимости, равный 0.003.
Таким образом, при увеличении температуры на 1°C, относительная плотность азота уменьшается на 0.003 относительной плотности при 0°C.
Плотность и плавучесть
Сравнение двух тел с плотностью больше и меньше единицы.
Плотность может указывать на плавучесть тела по отношению к пресной воде. Действительно, если плотность тела больше 1, как у металлического винта (см. Иллюстрацию), рассматриваемое тело тонет в воде. И наоборот, если плотность тела меньше 1, как у пробки (см. Иллюстрацию), рассматриваемое тело плавает по воде. В морской воде или в солевом растворе с градиентом солевого раствора эти значения необходимо откорректировать.
Частный случай жидкой воды
Обычно, когда жидкое тело охлаждается, его плотность увеличивается и становится максимальной при температуре затвердевания. Кроме того, твердое тело обычно более плотное, чем жидкое. Вода — одно из исключений: ее максимальная плотность достигается не при ° C, а при 3,98 ° C, а лед менее плотен, чем жидкая вода. Это отрицательное тепловое расширение позволяет теплую воду, очень холодную воду и лед , плавающую на воду при 3,98 ° С .
Среди менее плотных металлов в твердом состоянии, чем в жидком, можно упомянуть висмут и плутоний . Это создает значительные проблемы во время формования из-за набухания, которое сопровождает затвердевание .
Примеры
| Материал | Удельный вес |
|---|---|
| Бальзовое дерево | 0,2 |
| Дубовая древесина | 0,75 |
| Спирт этиловый | 0,78 |
| Оливковое масло | 0,91 |
| вода | 1 |
| Айронвуд | 1.5 |
| Графитовый | 1,9–2,3 |
| Столовая соль | 2,17 |
| Алюминий | 2,7 |
| Цемент | 3,15 |
| Железо | 7,87 |
| Медь | 8,96 |
| Свинец | 11,35 |
| Меркурий | 13,56 |
| Обедненный уран | 19,1 |
| Золото | 19,3 |
| Осмий | 22,59 |
(Образцы могут отличаться, и эти цифры являются приблизительными.) Вещества с относительной плотностью 1 обладают нейтральной плавучестью, вещества с RD больше единицы плотнее воды и поэтому (без учета эффектов поверхностного натяжения ) будут в ней тонуть, а вещества с RD меньше единицы менее плотны, чем вода, и поэтому будут плавать.
Пример:
- рDЧАС2Ознак равноρMатеряалρЧАС2О знак равнорD,{\ displaystyle RD_ {H_ {2} O} = {\ frac {\ rho _ {\ mathrm {Material}}} {\ rho _ {\ mathrm {H_ {2} O}}}} \ = RD,}
Газообразный гелий имеет плотность 0,164 г / л; он в 0,139 раза плотнее воздуха, имеющего плотность 1,18 г / л.
- Обычно моча имеет удельный вес от 1,003 до 1,030. Диагностический тест на удельный вес мочи используется для оценки способности почек к концентрации для оценки мочевыделительной системы. Низкая концентрация может указывать на несахарный диабет, а высокая концентрация может указывать на альбуминурию или глюкозурию.
- Кровь обычно имеет удельный вес примерно 1,060.
- Водка 80 ° proof (40% об.) Имеет удельный вес 0,9498.
Примечания и ссылки
Заметки
- Действительно, вода имеет особенность среди жидкостей: ее плотность и плотность максимальны не при температуре плавления ( ° C ), как у большинства жидкостей, а при 3,98 ° C или в метрологии, принимая за эталон физический свойство, которое проходит через экстремум , очень интересно: в окрестности этого экстремума физическое свойство меняется очень мало. Таким образом, в районе 3,98 ° C неточность определения точной температуры очень мало влияет на плотность воды и, следовательно, на результат измерения плотности.
Рекомендации
- JP Mathieu, A. Kastler, P. Fleury, Physics Dictionary , 2- е изд. , Masson Eyrolles, Париж, 1985 ( ISBN 2-225-80479-6 ) ; Le Petit Larousse 2008, изд. Ларусс, Париж ( ISBN 978-2-03-582503-2 ) , стр. 303
- ↑ и
- Эли Леви, Физический словарь , PUF , Париж, 1988, стр. 217
- Технический сувенир воды , т. 1 , Degrémont, 1989, приложение к форме
- Гастон Тиссандье, Научные развлечения или обучение через игры, физика без приборов, химия без лаборатории, дом любителя науки …, Париж, Массон, 1886, 323 с.
- Словарь биологических и физических констант в медицине , практическое клиническое применение, 6- е изд. , Малоан, Париж, 1991 ( ISBN 2-224-01907-6 )
Формула расчета относительной плотности по воздуху
Относительная плотность по воздуху — это величина, которая показывает, насколько материал легче или тяжелее воздуха. Она выражается в безразмерных единицах и может быть рассчитана по формуле:
p/ρ0,
где p — плотность материала, а ρ0 — плотность воздуха при стандартных условиях (обычно принимается значение 1,2 кг/м³). Для измерения относительной плотности по воздуху используются специальные приборы — гидростатические весы или пикнометры. Они позволяют определить плотность материала и сравнить ее с плотностью воздуха. Результаты измерений могут быть использованы для выбора материалов при проектировании и изготовлении различных изделий.
Воздушная среда и азот
Азот является непокрашенным, безвкусным и не реагирует с другими веществами при обычных условиях. Имея форму N2, молекулы азота имеют двойные связи между атомами, что делает его крайне стабильным. В сочетании с кислородом, азот играет важную роль в поддержании жизни на Земле.
Относительная плотность азота по воздуху определяется, как соотношение массы азота к объему воздуха, при условии, что плотность воздуха равна 1. Стандартное значение для относительной плотности азота по воздуху составляет примерно 0.967.
Плотность азота воздухе позволяет ему поддерживать сравнительно постоянные характеристики атмосферного давления и обеспечивать стабильные условия для жизни на планете. Кроме того, плотность азота играет важную роль в газовом анализе и различных технических процессах, таких как производство удобрений, пищевая промышленность и промышленность энергетики.
Изучение и понимание относительной плотности азота по воздуху является важным для научных исследований и технического развития, так как позволяет оценить влияние азота на различные процессы и создать условия для их оптимизации.






















