Физические и химические качества вещества
По физическим свойствам является жидким веществом без цвета, со своеобразным запахом побочного продукта спиртового брожения. Плотность вещества — вязкая. Справочное значение густоты составляет 0,81 г/см3, молярная масса 74,12 г/моль. Для него свойственно смешивание с органическими растворителями и водой, но только в малых соотношениях. Втор-бутиловый и трет-бутанол перемешиваются в любых количествах. Температура кипения при соединении с растворителем зависит от него и разнится от его вида. Расчет величины будет зависеть и от количества добавленного бутанола-1.
Третичный бутиловый спирт выступает в виде крепкой субстанции пахнущей плесенью. Плавится при температуре 25 градусов.
Если рассматривать химические особенности бутанола, то нужно сказать о том, что он относится к алифатическим спиртам. Имеет способность окисляться. Соединяясь с пентаном при десяти градусах, формирует соль борной кислоты, а взаимодействуя с альдегидами — простыми эфирами неустойчивых геминальных диолов. Окисление втор-бутилового, трет-бутилового продукта производит кислоты и сложные эфиры. К примеру, из бутанола, наряду с масляной кислотой, получается бутиловый эфир масляной кислоты.
https://youtube.com/watch?v=wgF3DVfpgb0
Ссылки
- Моррисон, Р. Т. и Бойд, Р., Н. (1987). Органическая химия. 5-е издание. Редакция Addison-Wesley Interamericana.
- Кэри Ф. (2008). Органическая химия. (Издание шестое). Мак Гроу Хилл.
- Грэм Соломонс Т.В., Крейг Б. Фрайл. (2011). Органическая химия. (10-е изд.). Wiley Plus.
- Стивен А. Хардинджер. (2017). Иллюстрированный глоссарий органической химии: втор-бутил. Получено с: chem.ucla.edu
- Джеймс Эшенхерст. (2020). Не будьте Futyl, изучите Butyls. Получено с: masterorganicchemistry.com
- Wikipedia. (2020). Категория: Втор-бутиловые соединения. Получено с: commons.wikimedia.org
История открытия
Первооткрывателем ацетилена стал Эдмунд Дэви, он в 1836 году получил его методом нагрева уксуснокислого калия с древесным углем, реакцией которых с водой образовался карбида калия. Дэви, полученному газу дал название «двууглеродистого водорода».
Ф. Вёлер, немецкий химик и врач, в 1862 году с помощью действий воды и карбида кальция также открыл ацетилен.
А вот французский химик М. Бертло дал этому газу имя «ацетилен», так как получил его способом, пропустив водород над раскаленными электрической дугой графитовыми электродами.
Русское же название «ацетилен» появилось благодаря Д. И. Менделееву.
Физические и химические свойства
Формула анилина — C6H5NH2 содержит аминогруппу, поэтому вещество имеет второе название — фениламин. А также благодаря присутствию бензольной группы, он известен как аминобензол.
По своим физическим свойствам анилин — это бесцветная маслянистая жидкость, малорастворимая в воде. Имеет неприятный аммиачный запах. При горении образует яркое коптящее пламя. Температура кипения анилина составляет 184,4 °C. Это горючее вещество — при нагревании выше 70 °C могут образоваться взрывоопасные соединения. На воздухе анилин легко окисляется и приобретает красно-бурый цвет.
Благодаря химическим свойствам взаимодействует с сильными неорганическими кислотами (соляная, серная, фосфорная) и образует соли.
Свойства анилина
Ксилол: основные свойства и применение
Ксилол – это органическое соединение, принадлежащее к группе ксилолов, производных бензола. Оно представляет собой прозрачную жидкость, которая имеет специфический сильный запах. Ксилол может быть смесью из трех изомеров: ортоксилола (o-ксилола), метаксилола (m-ксилола) и параксилола (p-ксилола).
Основные свойства ксилола:
- Физические свойства: ксилол представляет собой бесцветную жидкость, которая плохо смешивается с водой. Его плотность составляет приблизительно 0,87 г/мл, а его кипение происходит в диапазоне от 137 до 140 градусов Цельсия.
- Химические свойства: ксилол является химически стабильным соединением, устойчивым к окислению и коррозии. Он может реагировать с некоторыми органическими и неорганическими соединениями.
- Токсичность: ксилол является веществом, обладающим определенной степенью токсичности. При неправильном использовании может вызывать различные заболевания, такие как головные боли, слабость и даже повреждение органов, таких как почки и печень.
Применение ксилола:
- Ксилол находит широкое применение в промышленности в качестве растворителя и средства для разбавления красок, лаков и смол. Он также используется в процессе производства различных химических веществ, включая пластик, синтетические волокна и резины.
- Ксилол является важным компонентом в процессе изготовления этилового и терафталевого альдегидов. Он также используется в производстве фармацевтических препаратов и антиоксидантов.
- Ксилол также находит применение в лабораториях для различных химических экспериментов и исследований.
В целом, ксилол является важным химическим соединением, которое широко используется в различных отраслях промышленности и научных исследований.
Реферат патента 1991 года Способ очистки сырого втор-бутилового спирта
Изобретение касается производства спиртов, в частности очистки сырого втор-бутанола — промышленного полупродукта в органическом синтезе. Цель — повышение степени очистки. Для этого ведут ректификацию сырого спирта, который подают на 5-ю или 10-ю тарелку, считая от верха колонны с 55-85 практическими тарелками. Процесс ведут при 82,3-83,4°С и атмосферном давлении в присутствии воды, взятой в количестве 7,6-19,7% от массы головного продукта, при соотношении рециркулируемого головного продукта и сырого спирта (1,7-2,6):, соотношении концентраций втор-бутанола и дивтор-бутилового эфира в отводимом азеотропном головном продукте, равном (0,7-2,8):, и при поддержании 89-91°С для тарелки в средней части колонны. Затем проводят конденсацию. Эти условия обеспечивают получение очищенного целевого продукта с содержанием 0,01 мас.% воды, менее 0,001 мас.% трет-бутилового и 0,001 мас.% дивтор-бутилового эфира против 0,035-0,07 мас.% воды и 1 мас.%- дивтор-Путилового эфира и других примесей в известном случае. 4 ил,, 1 табл. сл с
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Безопасность при использовании второго бутила
Первое, что необходимо помнить, это то, что второй бутил является воспламеняющимся веществом
Поэтому при его использовании необходимо принимать меры предосторожности, чтобы избежать возгорания. Работа с вторым бутилом должна проводиться только в хорошо проветриваемых помещениях с использованием специального оборудования и средств индивидуальной защиты
Также следует избегать смешивания второго бутила с веществами, которые могут вызывать химические реакции или образование взрывоопасных смесей.
Второй бутил также является раздражающим веществом. При попадании на кожу или в глаза может вызывать раздражение, сухость и покраснение. Для предотвращения контакта с кожей рекомендуется использовать специальные рукавицы и защитные очки. В случае контакта следует немедленно промыть затронутую область водой и обратиться за медицинской помощью при необходимости.
Еще одним аспектом безопасности является правильное хранение и утилизация второго бутила. Он должен храниться в специальных контейнерах, которые обеспечивают его сохранность и предотвращают возможность утечки или испарения
При выбросе или утилизации второго бутила необходимо соблюдать все меры предосторожности и соблюдать местные нормы и правила
В целом, использование второго бутила требует строгого соблюдения мер безопасности. Работники, занимающиеся с этим веществом, должны быть обучены правилам безопасного обращения с ним и иметь доступ к необходимому оборудованию и средствам защиты. Безопасность должна быть приоритетом при работе с любым химическим веществом, включая второй бутил.
Применение второго бутила
|
Производство пластмасс и синтетических каучуков Второй бутил широко применяется в качестве растворителя и промежуточного продукта в процессах производства пластмасс и синтетических каучуков. Он используется в реакционных средах для получения полимеров с заданными характеристиками и свойствами. |
Производство лакокрасочных материалов Второй бутил применяется в производстве лакокрасочных материалов в качестве растворителя для различных пигментов и смол. Он обладает хорошими растворяющими свойствами и способен эффективно выделять цвет и отделять глянцевые пленки. |
|
Нефтехимический комплекс Второй бутил используется в нефтехимическом комплексе в качестве растворителя для различных компонентов, таких как катализаторы и реагенты. Он также может использоваться для извлечения ценных химических соединений из сырой нефти или природного газа. |
Производство фармацевтических препаратов Второй бутил играет важную роль в производстве фармацевтических препаратов. Он может использоваться для извлечения активных компонентов из растений и других природных источников. Также он может служить растворителем для различных ингредиентов в процессе синтеза и формулирования лекарственных средств. |
|
Ароматизаторы и парфюмерия Второй бутил может использоваться в производстве ароматизаторов и парфюмерии в качестве основы или растворителя для различных ароматических компонентов. Он способен сохранять и передавать запахи и ароматы, что делает его важным компонентом в процессе создания парфюмерных продуктов. |
Научные исследования Второй бутил широко используется в химических исследованиях, где он может служить растворителем, индикатором или реагентом в различных экспериментах. Его специфические свойства и стабильность позволяют использовать его в различных химических реакциях и процессах. |
Таким образом, второй бутил является важным химическим веществом, находящим широкое применение в различных отраслях промышленности и научных исследований.
свойства
-Структурная формула бутино (независимо от того, какой изомер упоминается) является C4H6, которая имеет линейную структуру.
-Одной из химических реакций, испытываемых молекулой бутина, является изомеризация, при которой внутри молекулы происходит перегруппировка и миграция тройной связи..
-1-бутин находится в газовой фазе, имеет очень высокую воспламеняемость и более высокую плотность, чем воздух.
-Это вещество также довольно реактивно, и в присутствии тепла может вызвать сильные взрывы.
-Кроме того, когда этот бесцветный газ испытывает неполную реакцию горения, это может вызвать угарный газ (СО)
-Когда оба изомера подвергаются воздействию высоких температур, они могут испытывать реакции полимеризации взрывного типа..
-2-бутин находится в жидкой фазе, хотя он также считается довольно легковоспламеняющимся при стандартных условиях давления и температуры.
-Эти вещества могут испытывать бурные реакции, когда они находятся в присутствии сильных окисляющих веществ..
-Точно так же экзотермические реакции с последующим выделением газообразного водорода происходят в присутствии восстанавливающих частиц..
-При контакте с определенными катализаторами (такими как некоторые кислотные вещества) или стартовыми веществами могут происходить реакции полимеризации экзотермического типа..
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
|
WO2013142127A1 * |
2012-03-22 | 2013-09-26 | Uop Llc | Production of alkane sulfonates |
|
US9108906B2 |
2012-03-22 | 2015-08-18 | Uop Llc | Production of alkane sulfonates |
|
RU2597929C2 * |
2012-03-22 | 2016-09-20 | Юоп Ллк | Получение тяжелых алкансульфонатов |
|
RU2777331C2 * |
2017-03-31 | 2022-08-02 | Джонсон Мэтти Каталистс (Джермани) Гмбх | Катализатор селективного каталитического восстановления |
|
RU2777330C2 * |
2017-03-31 | 2022-08-02 | Джонсон Мэтти Каталистс (Джермани) Гмбх | Катализатор селективного каталитического восстановления |
Топ-5 лучших статьи
Как рассчитать количество материалов для шумоизоляции квартиры
Итак, вы приняли решение сделать в квартире шумоизоляцию. Сколько это стоит? Зная площадь помещения, можно с высокой точностью рассчитать количество материалов, а затем и бюджет. Рассмотрим базовые принципы расчета на примере стандартной комнаты.
Подробнее…
Как звукоизолировать студию звукозаписи
Уровень децибелов в студиях звукозаписи порой зашкаливает. Репетиции, запись, сведение, озвучивание, дубляж – все это доставляет немалые неудобства соседям, если звук просачивается через стены, пол или потолок.
Подробнее…
Сколько стоит звукоизоляция спальни 12 м2/детской 15 м2/кабинета 8 м2?
Вечеринки, громкие разговоры и смех хороши до поры до времени. Рано или поздно хочется уединиться в тишине, в собственной комнате.
Подробнее…
Что нужно знать про индекс звукоизоляции, когда делаешь шумоизоляцию
В системы звукоизоляции включают звукоизолирующие и шумопоглощающие материалы, которые действуют по-разному. Определить эффективность звукозащитной конструкции помогают общепринятые показатели – индекс звукоизоляции и коэффициент шумопоглощения.
Подробнее…
Что такое бутиловая лента
Бутиловая лента – это современный герметизирующий материал, который широко используется в частном и коммерческом строительстве.
Подробнее…
Химические свойства радикалов C2H5, C3H7, C4H9
Радикалы C2H5, C3H7, C4H9 представляют собой углеводородные группы, которые являются одной из основных составных частей органических соединений. Они обладают рядом уникальных химических свойств, которые определяют их реактивность и способность к участию в различных химических реакциях.
1. Реакция с водой:
- Радикал C2H5 (этиловый) при контакте с водой образует этиловый спирт (C2H5OH), который является одним из наиболее распространенных органических растворителей.
- Радикал C3H7 (пропиловый) также реагирует с водой, образуя пропиловый спирт (C3H7OH).
- Радикал C4H9 (бутиловый) образует бутиловый спирт (C4H9OH) при взаимодействии с водой.
2. Окисление:
- Все рассмотренные радикалы могут подвергаться окислению под действием кислорода воздуха или окислителей.
- Окисление радикалов C2H5, C3H7, C4H9 может привести к образованию соответствующих карбонильных соединений, например, альдегидов и кетонов.
3. Восстановительные реакции:
- Радикалы C2H5, C3H7, C4H9 могут выступать в качестве восстановителей в химических реакциях.
- Они способны превращаться в соответствующие алкены (ненасыщенные углеводороды) путем удаления атомов водорода.
4. Реакция с кислородом:
- Радикалы C2H5, C3H7, C4H9 реагируют с кислородом под воздействием искры или нагревания.
- Эта реакция может привести к образованию горючих веществ, таких как этилен (C2H4), пропилен (C3H6) или бутен (C4H8).
Таким образом, радикалы C2H5, C3H7, C4H9 имеют широкий спектр химических свойств, которые делают их важными строительными блоками в органической химии и позволяют использовать их в различных технологических процессах.
Химическая структура
В молекуле, известной как бутино, представлено явление структурной изомеризации положения, которое заключается в наличии одинаковых функциональных групп в обоих соединениях, но каждое из них находится в другом месте цепи..
В этом случае обе формы бутино имеют одинаковую молекулярную формулу; однако в 1-бутине тройная связь находится в углероде номер один, а в 2-бутине — в номер два. Это превращает их в положение изомеров.
Из-за расположения тройной связи в одном из терминалов 1-бутиновой структуры он рассматривается как терминальный алкин, а промежуточное положение тройной связи в 2-бутиновой структуре дает ему классификацию внутреннего алкина..
Таким образом, связь может быть только между первым и вторым углеродом (1-бутином) или между вторым и третьим углеродом (2-бутином). Это связано с применяемой номенклатурой, где наименьшая возможная нумерация всегда будет дана позиции тройной связи.
1-бутин
Соединение, называемое 1-бутином, также известно как этилацетат, из-за его структуры и способа, которым его четыре атома углерода расположены и связаны. Тем не менее, когда речь идет о бутин ссылка делается только на этот химический вид.
В этой молекуле тройная связь обнаружена в концевом углероде, что обеспечивает доступность атомов водорода, которые придают ей большую реакционную способность..
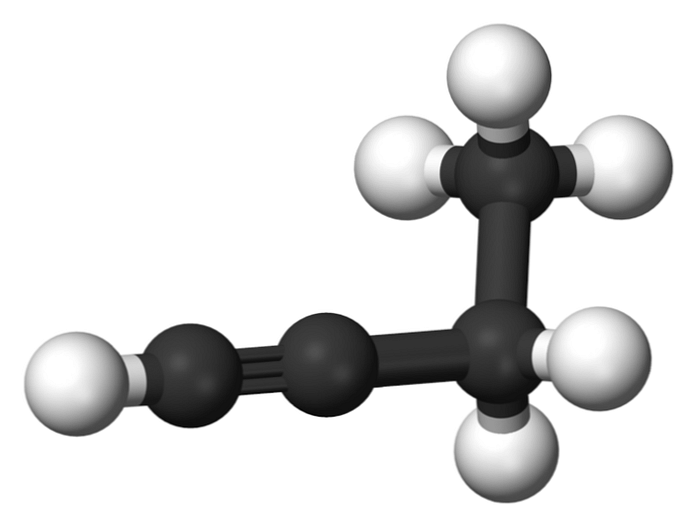
Эта жесткая и прочная связь, чем простая или двойная связь между атомами углерода, обеспечивает стабильную конфигурацию 1-бутина линейной геометрии.
С другой стороны, это газообразное вещество довольно легко воспламеняется, поэтому при наличии тепла оно может легко вызвать пожары или взрывы и обладает высокой реакционной способностью в присутствии воздуха или воды..
2-бутин
Поскольку внутренние алкины проявляют большую стабильность, чем концевые алкины, они позволяют превращать 1-бутин в 2-бутин.
Эта изомеризация может происходить при нагревании 1-бутина в присутствии основания (такого как NaOH, KOH, NaOCH3 …) или при перегруппировке 1-бутина в растворе гидроксида калия (KOH) в этаноле (C2H6O).
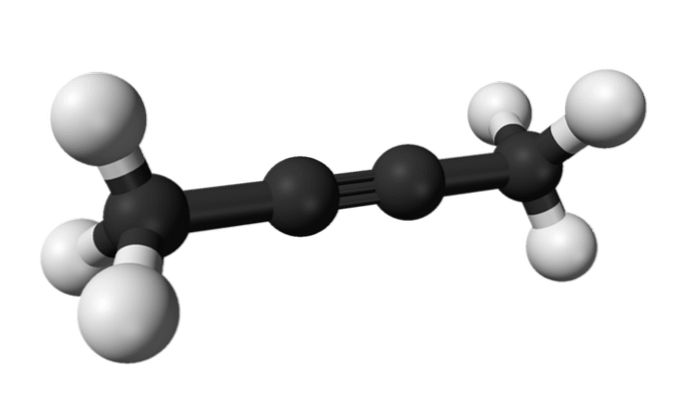
Таким же образом, химическое вещество, известное как 2-бутин, также называют диметилацетиленом (или кротониленом), представляющим собой жидкое и летучее вещество, которое происходит искусственно.
В 2-бутине тройная связь находится в середине молекулы, что придает ей большую стабильность, чем ее изомер..
Кроме того, это бесцветное соединение имеет меньшую плотность, чем вода, хотя оно считается нерастворимым в нем и обладает высокой воспламеняемостью..
Втор-бутилацетат
|
Удельная активность микроорганизмов, катализирующих гидролиз. |
Изучение кинетики гидролиза втор-бутилацетата найденными микроорганизмами в течение 10 часов показало, что 10 штаммов сохранили достигнутый к 5 часам уровень конверсии, тогда как 4 штамма продолжают конвертировать субстрат дальше.
Бутиловый спирт идет на производство метилэтилкетона и втор-бутилацетата, применяется как растворитель нитратцеллюлозных лаков, как компонент гидротормозных жидкостей.
Вторичный бутиловый спирт идет на производство метил-этилкетона и втор-бутилацетата, применяется как растворитель нитроцеллюлозных лаков, а также как компонент гидротормозных жидкостей.
|
Удельная активность микроорганизмов, катализирующих гидролиз. |
Исследование способности найденных ферментных препаратов и клеток микроорганизмов трансформировать рацемический втор-бутилацетат и этил-3 — оксибутират в течение 5 часов позволило отобрать штаммы, гидролизующие эти соединения с конверсией близкой к 50 % уровню ( 14 и 11 штаммов, соответственно), что соответствует теоретически возможному выходу в процессах кинетического разделения рацемических смесей органических соединений.
С целью поиска оптимальных условий трансформации этил-3 — оксибутирата и втор-бутилацетата изучено влияние кислотности среды ( рН), температуры, начальной концентрации субстрата и сорастворителя на активность биокатализаторов.
Для получения препаративных количеств оптически активных этил-3 — оксибутирата, втор-бутилацетата, втор-бутанола и оксимасляной кислоты разработана принципиальная схема кинетического разделения рацемических смесей гидролизом эфиров в воде.
Созданы препаративные методы получения ( S) — () — втор-бутанола, ( К) — ( -) — втор-бутилацетата, ( ![]() — () — этил-3 — оксибутирата, ( R) — ( -) — этил-3 — оксибутирата, (
— () — этил-3 — оксибутирата, ( R) — ( -) — этил-3 — оксибутирата, ( ![]() — () — 3-оксимасляной кислоты, ( К) — ( -) — 3-оксимасляной кислоты, ( S) — () — глицидола и ( К) — ( -) — глицидола высокой оптической чистоты ( 96 — 100 % ее), которые являются ценными синтонами при получении различных низкомолекулярных биорегуляторов ( феромонов насекомых, ( 3-адренергетиков, цереброзидов, гормонов, простагландинов, нуклеозидов) и биоразлагаемых полимеров.
— () — 3-оксимасляной кислоты, ( К) — ( -) — 3-оксимасляной кислоты, ( S) — () — глицидола и ( К) — ( -) — глицидола высокой оптической чистоты ( 96 — 100 % ее), которые являются ценными синтонами при получении различных низкомолекулярных биорегуляторов ( феромонов насекомых, ( 3-адренергетиков, цереброзидов, гормонов, простагландинов, нуклеозидов) и биоразлагаемых полимеров.
Применение разработанной принципиальной схемы ( рис. 6) разделения рацемических эфиров органической фазе позволило получить ( К) — () — втор-бутилацетат с выходом 87 % ( от теоретически возможного при данной конверсии эфира) и оптической чистотой 99 % ее.
Объектами исследования являлись микроорганизмы, полученные на предыдущем этапе работы , клетки которых в стандартных условиях осуществляли стереоселективный гидролиз рацемических смесей втор-бутилацетата ( штамм 79 — 54), этил-3 — оксибутирата ( штамм 78 — 5), а также парциальное ацилирование гептанола-2 винилацетатом ( штаммы 77 — 47 и 77 — 33) с образованием энантиомерных соединений высокой оптической чистоты и выходом, близким к теоретическому.
Объектами биотрансформации являлись липолитические микроорганизмы синтезирующие внеклеточные или внутриклеточные липазы, выделенные из почвенных образцов, взятых с различных участков химических производств Республики Башкортостан и Сибири, а также втор-бутилацетат, этил-3 — оксибутират, глицидиловый эфир метакриловой кислоты и М — ЗЕ-пентен-2-ил-ортотолуидин ацетамид.
В результате сравнительного анализа принципиальных схем разделения в водной ( рис. 5) и в органической ( рис. 6) средах установлено, что получение оптически активных остаточных субстратов — втор-бутилацетата и этил-3 — оксибутирата предпочтительнее проводить в гексане вследствие меньшей трудоемкости и большей эффективности разделения.
Найдены оптимальные параметры энантиоселективного гидролиза ( температура 30 — 35 С; рН7 5 — 8 0; начальная концентрация субстрата 5 — 7 г / л; концентрация сорастворителя 30 — 35 % об. в зависимости от типа штамма) втор-бутилацетата и этил-3 — оксибутирата для полученных биокатализаторов.
|
Удельная активность микроорганизмов, катализирующих гидролиз. |
Механизм реакции гидролиза хлористого бутила
Механизм реакции гидролиза хлористого бутила может быть представлен следующим образом:
-
Начальным этапом является диссоциация хлористого бутила в растворе. Он разбивается на ион натрия (Na+) и ион хлорида (Cl-).
C4H9Cl -> C4H9+ + Cl-
-
Затем ион натрия (Na+) связывается с молекулой воды (H2O), образуя ион натрия гидроксида (NaOH):
Na+ + H2O -> NaOH
-
На этапе атаки нуклеофила ион гидроксида (OH-) атакует положительно заряженный углерод хлористого бутила, образуя алкоксид (R-O-) и ион хлорида:
C4H9+ + OH- -> C4H9O- + Cl-
-
Образовавшийся алкоксид (R-O-) затем реагирует с протонированным ионом водорода (H+) и создает соответствующий спирт (бутиловый спирт):
C4H9O- + H+ -> C4H9OH
-
Освобождение иона хлорида (Cl-) происходит при образовании бутилового спирта:
Cl- + H+ -> HCl
Таким образом, реакция гидролиза хлористого бутила приводит к образованию бутилового спирта и водорода хлорида.
Примеры летучих органических соединений
Летучие органические соединения являются одной из наиболее широко распространенных групп веществ в нашей повседневной жизни. Они могут быть обнаружены во многих природных и искусственных материалах, а также в различных продуктах, которые мы используем ежедневно.
Ниже приведены некоторые примеры летучих органических соединений:
- Этанол — также известный как спирт или алкоголь, этанол является основным компонентом алкогольных напитков, таких как пиво, вино и водка. Он также широко используется в качестве растворителя и дезинфицирующего средства.
- Ацетон — это органическое соединение, которое обычно используется в качестве растворителя и очистителя. Он часто применяется для удаления лакокрасочных покрытий, клея и других загрязнений.
- Бензол — это летучее соединение, используемое в производстве различных продуктов, включая пластмассы, краски и лекарственные препараты. Бензол также может быть найден в выхлопных газах автомобилей и природном газе.
- Толуол — это химическое соединение, которое обычно используется в производстве красок, клеев и растворителей. Он может также присутствовать в выхлопных газах автомобилей и табачном дыме.
- Метан — это простейший углеводород, который является основным компонентом природного газа. Метан также является продуктом биологического распада органических веществ и может быть обнаружен в животных и человеческих отходах.
Это только некоторые примеры летучих органических соединений. Обнаружение и изучение этих веществ играет важную роль в различных научных и промышленных областях, а также в охране окружающей среды и здоровья.
Номенклатура и обучение
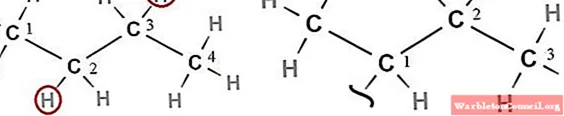
Известно, что секбутил происходит из п-бутан, линейный изомер бутана, C4ЧАС10 (слева от верхнего изображения). Поскольку R связан с любым из двух своих предпоследних атомов углерода, рассматриваются только атомы углерода 2 и 3. Эти атомы углерода должны потерять один из своих двух атомов водорода (в красных кружках), разрывая связь C-H и образуя вторбутильный радикал.
Как только этот радикал будет включен или связан с другой молекулой, он станет секбутильной группой или заместителем (справа от изображения).
Обратите внимание, что R может быть связан либо с углеродом 2, либо с углеродом 3, причем оба положения эквивалентны; то есть в результате не будет структурной разницы, помимо того факта, что два атома углерода являются вторичными или вторыми. Таким образом, поместив R на углерод 2 или 3, будет создано соединение на первом изображении
С другой стороны, стоит упомянуть, что эта группа наиболее известна под названием «секбутил»; однако, согласно систематической номенклатуре, его правильное название — 1-метилпропил. или 1-метилпропил. Вот почему секбутильные атомы углерода на изображении выше (справа) пронумерованы до 3, причем углерод 1 является тем, который связывается с R и CH.3.
Номенклатура [ править ]
Согласно номенклатуре ИЮПАК , названия «изобутил», « втор- бутил» и « трет- бутил» допускаются. Последнее руководство изменило это: только трет- бутил остается в качестве предпочтительного префикса, все другие названия бутила удалены. Согласно соглашению скелетных формул , каждое окончание линии и пересечение линии указывает атом углерода (если не указано иное), насыщенный односвязными атомами водорода (если не указано иное). Символ «R» указывает на любой радикал или другую неспецифическую функциональную группу.
| Формула скелета | Распространенное имя | Предпочтительное название IUPAC | (Старое) Систематическое название | Альтернативное обозначение |
|---|---|---|---|---|
| н- бутил | бутил | бутил | бутан-1-ил | |
| втор- бутил | бутан-2-ил | 1-метилпропил | бутан-2-ил | |
| изобутил | 2-метилпропил | 2-метилпропил | 2-метилпропан-1-ил | |
| трет- бутил | трет- бутил | 1,1-диметилэтил | 2-метилпропан-2-ил |
Бутил является самым большим заместителем, для которого обычно используются тривиальные названия всех изомеров.
Углерод бутильной группы, который связан с остальной частью (R) молекулы, называется первичным углеродом R I или R [ необходима цитата ] . Префиксы sec (от «вторичный») и tert (от «третичный») относятся к числу дополнительных боковых цепей (или атомов углерода), связанных с первым бутильным атомом углерода. Префикс «iso» (от «изомер») означает «равно», а префикс « n- » означает «нормальный».






























