Основные свойства индивидуального вещества
Основные свойства индивидуального вещества:
1. Физические свойства:
Индивидуальное вещество имеет определенную массу, объем и плотность. Оно обладает определенной температурой плавления и кипения, а также фиксированными значениями других физических свойств, таких как цвет, запах, прозрачность и т.д.
2. Химические свойства:
Индивидуальное вещество обладает уникальными химическими свойствами, которые определяют его способность реагировать с другими веществами. Оно может подвергаться химическим изменениям при взаимодействии с различными реагентами, что приводит к образованию новых веществ.
Например, металл кобальт взаимодействует с кислородом воздуха, образуя оксид кобальта.
3. Фазовый состав:
Индивидуальное вещество может находиться в различных фазовых состояниях – твердом, жидком или газообразном. Фазовый переход может происходить при изменении температуры и давления.
4. Реакционная способность:
Индивидуальное вещество может проявлять различную реакционную способность в зависимости от среды и условий, в которых оно находится. Некоторые вещества могут быть активными и легко реагировать с другими веществами, в то время как другие могут быть инертными и не проявлять химической активности.
Индивидуальное вещество является основным объектом изучения химии и имеет важное значение в различных сферах науки и технологий
Изменение состояния индивидуального вещества
При повышении температуры твердое вещество может перейти в жидкое состояние — это называется плавление. Молекулы вещества при этом начинают двигаться быстрее, что приводит к разрушению кристаллической решетки. Также можно сказать, что межмолекулярные силы преодолеваются.
Дальнейшее повышение температуры приводит к испарению жидкости. Это происходит из-за того, что молекулы начинают двигаться с большей энергией и могут покинуть поверхность жидкости. Процесс испарения также сопровождается поглощением тепла.
Обратный процесс — конденсация, происходит при охлаждении пара. Молекулы пара теряют энергию и объединяются в жидкость. Это связано с выделением тепла.
Изменение давления также может вызвать изменение состояния вещества. При низком давлении газ может перейти в жидкое состояние — конденсироваться. При высоком давлении жидкость может перейти в газообразное состояние — испариться.
Таким образом, изменение состояния индивидуального вещества происходит под влиянием изменения температуры и давления. Эти процессы находят широкое применение в жизни и технике. Знание этих процессов позволяет понять многое о свойствах вещества и использовать их в практических целях.
Свойства индивидуальных химических веществ
1. Физические свойства:
- Температура плавления и кипения;
- Плотность, объем и масса;
- Цвет, запах и вкус;
- Растворимость в различных растворителях;
- Форма и состояние при различных условиях.
2. Химические свойства:
- Реакции с различными веществами;
- Стойкость к окислению, коррозии или разложению;
- Способность к образованию соединений;
- Проводимость электричества и тепла при растворении в воде или других растворителях;
- Способность к катализу или ингибированию реакций.
3. Биологические свойства:
- Токсичность, канцерогенность, мутагенность и другие воздействия на организмы;
- Фитотоксичность (влияние на рост и развитие растений);
- Гигиенические и санитарные характеристики (содержание вредных примесей, возможность использования в пищевой и фармацевтической промышленности и т.д.).
4. Экологические свойства:
- Биологическая разлагаемость;
- Влияние на окружающую среду при производстве, транспортировке, использовании, утилизации и хранении;
- Мобильность и устойчивость в природных условиях.
Пример 4: Соляная кислота
Соляная кислота является бесцветной жидкостью с резким запахом. Она является одним из наиболее распространенных кислотных соединений, используемых в индустрии. Она широко применяется для производства различных продуктов, включая пластик, удобрения, синтетические волокна, лекарства и многое другое.
Соляная кислота также имеет много других применений в нашей повседневной жизни. Ее можно найти в бытовых товарах, таких как моющие средства, средства для удаления накипи, а также в промышленности как очиститель и растворитель для металлов.
Однако следует быть осторожным при обращении с соляной кислотой, так как она является очень коррозивным веществом и может нанести вред нашему здоровью и окружающей среде.
Методы получения индивидуальных веществ
Методы получения индивидуальных веществ:
1. Синтез
Синтез — это химическая реакция, в результате которой из простых веществ образуется более сложное вещество. Синтез используется, когда нужно получить определенное индивидуальное вещество с помощью соединения простых веществ в определенных пропорциях. Например, для получения воды (H2O) необходимо соединить водород (H2) и кислород (O2) в соотношении 2:1.
2. Разложение
Разложение — это химическая реакция, в результате которой сложное вещество распадается на простые компоненты. Разложение может быть термическим, электролитическим или химическим. Например, для получения кислорода (O2) можно разложить перекись водорода (H2O2) с помощью катализатора.
3. Химические реакции
Индивидуальные вещества могут быть получены также с помощью различных химических реакций. Например, осаждение — это реакция, при которой из раствора выпадает твердое вещество. Для получения твердого хлорида натрия (NaCl) можно осаждать его из раствора путем реакции между хлоридом натрия (NaCl) и реагентом, содержащим хлор (Cl).
4. Экстракция
Экстракция — это метод получения вещества из смеси с использованием различных растворителей. Этот метод основан на различии в растворимости компонентов смеси. Например, для получения каротина — вещества, ярко-красящего морковь, можно использовать экстракцию этого пигмента из морковного сока с помощью спирта.
5. Изоляция
Изоляция — это метод получения вещества путем выделения его из природных источников или других смесей. Например, для получения меди (Cu) можно использовать изоляцию путем обработки руды меди.
Каждый из этих методов имеет свои преимущества и недостатки и подходит для получения определенного индивидуального вещества в зависимости от его свойств и целей его использования.
Смеси
Смеси — это вещества, в состав которых входят элементы или соединения, не вступившие в химические реакции друг с другом. Это означает, что компоненты смеси перемешаны между собой, но не связаны химической связью, и их легко можно разделить. Например, перемешав металлические кнопки с осколками стекла, мы получим смесь. Для того чтобы извлечь из нее кнопки, нужно всего лишь поднести магнит, который притянет все металлические предметы. Несложно выделить чистый песок из смеси соли и песка. Для этого необходимо поместить смесь в воду, хорошо перемешать, дождаться полного растворения соли и отфильтровать раствор.
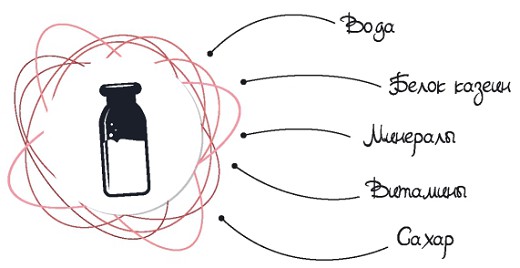 Молоко — это смесь воды с мельчайшими частицами молочного жира, белка, минералов, витаминов и особого молочного сахара — лактозы
Молоко — это смесь воды с мельчайшими частицами молочного жира, белка, минералов, витаминов и особого молочного сахара — лактозы
А теперь давай посмотрим с точки зрения химии на тесто. Легко представить, что тесто — это тоже смесь, в состав которой входят различные «соединения»: мука, молоко, яйца, жиры, сахар и т.д.
Однако «смесью» тесто мы можем называть только до тех пор, пока оно не попало в духовку. Готовый пирог — это уже новое «соединение».

Чай с точки зрения химии
Обыкновенный чай, который ты пьешь, — это тоже пример смеси. И соотношение компонентов в ней может быть разным: кто-то любит покрепче и добавляет больше заварки, кто-то — послаще и кладет больше сахара, а кому-то нравится чай с лимоном или молоком. В каждом из этих случаев чай, или «смесь» с точки зрения химии, будет разным, несмотря на то что для его приготовления использовались одинаковые компонентов.
Примеры индивидуальных веществ
К индивидуальным веществам относятся соединения, которые имеют уникальные свойства и состоят из атомов одного вида. Они могут иметь определенную структуру или химическую формулу, что делает их уникальными и отличными от других веществ.
Примером индивидуального вещества является кислород (O2). Он представляет собой молекулу, состоящую из двух атомов кислорода, которые связаны между собой. Кислород является необходимым для дыхания и существования многих организмов, а его химические свойства делают его уникальным и отличным от других элементов.
Другим примером индивидуального вещества является хлор (Cl2). Он представляет собой молекулу, состоящую из двух атомов хлора, связанных между собой. Хлор широко используется в промышленности и в быту, и его химические свойства делают его уникальным и отличным от других элементов.
Еще одним примером индивидуального вещества является сера (S). Она представляет собой элементарный вещественный неметалл, обладающий характеристическими физическими и химическими свойствами. Сера широко используется в различных отраслях промышленности, включая производство удобрений, пластмасс и каучука.
Это лишь небольшой перечень примеров индивидуальных веществ. Каждое из них имеет свои уникальные химические и физические свойства, которые определяют его роль и значение в химических и естественных процессах.
Чистые вещества — что это в химии
Вещества, подходящие под это понятие, имеют постоянный состав (для веществ молекулярного строения) и постоянные свойства. В чистом, индивидуальном состоянии вещества наиболее ярко проявляют присущие им характеристики, поэтому часто используются в химии.
В Российской Федерации существует классификация реактивов по степени чистоты. Перечень основывается на доле примесей в составе:
- технический: содержит до 5% примесей и относится к низшей категории качества;
- чистый: процент чужеродных примесей до 2%;
- чистый для анализа: содержание основного компонента выше 98%, что позволяет использовать реактив для аналитических исследований;
- химически чистый: содержит в составе более 99% целевого компонента;
- особо чистый: содержание примесей настолько ничтожно, что влияния на свойства они практически не оказывают.
Примеры и особенности индивидуальных химических веществ
Хлор является газообразным элементом, относящимся к галогенам. Он имеет зеленоватый цвет и неприятный запах. Хлор встречается в природе в виде солей, таких как хлорид натрия. Он часто используется для очистки воды и в производстве пластмасс, текстиля и дезинфекционных средств. Хлор является довольно опасным веществом и может вызывать раздражение глаз и дыхательных путей.
Ацетон — это органическое вещество, которое имеет неприятный запах и легко испаряется. Он широко используется в различных отраслях промышленности, таких как производство пластмасс, лаков, растворителей и т.д. Ацетон является легко возгораемым веществом и должен храниться в специальных условиях.
Натрий — это металлический элемент, который является одним из основных элементов нашей планеты. Он имеет серебристо-белый цвет и мягкую текстуру. Натрий реагирует с водой, образуя натриевый гидроксид и выделяя водород. Натрий широко используется в производстве технических металлов, а также в качестве соли в пищевой промышленности.
- Хлор — газообразное вещество, используется в производстве и очистке воды;
- Ацетон — органическое вещество, используется в лакокрасочной промышленности;
- Натрий — металлический элемент, используется в производстве технических металлов и в пищевой промышленности.
| Вещество | Свойства |
|---|---|
| Хлор | Газообразное вещество с зеленоватым цветом и неприятным запахом. Широко используется в производстве и очистке воды. |
| Ацетон | Органическое вещество с неприятным запахом и легко испаряющимся. Широко используется в лакокрасочной промышленности. |
| Натрий | Металлический элемент с серебристо-белым цветом. Реагирует с водой, образуя натриевый гидроксид и выделяя водород. Широко используется в производстве технических металлов и в пищевой промышленности. |
Химический состав по массе и по объему
Состав химических соединений, а также состав смесей различных веществ и растворов выражают в массовых долях (массовых %), а состав смесей жидкостей и газов, кроме того, в объемных долях (объемных %).
Состав сложного вещества, выраженный через массовые доли химических элементов, называется составом вещества по массе.
Например, состав Н2О по массе:
То есть, можно сказать, что химический состав воды (по массе): 11,11% водорода и 88,89% кислорода.
Массовая доля компонента в механической смеси (W) – это число, показывающую, какую часть смеси составляет масса компонента от общей массы смеси, принятой за единицу или 100%.
W1 = m1/m(cм.), m(см.) = m1 + m2+ …. mn,
Где m1 – масса 1-го (произвольного)компонента, n – число компонентов смеси, m1 … mn – массы компонентов, образующих смесь, m(cм.) – масса смеси.
Например, массовая доля основного компонента:
W(осн. комп) = m(осн. комп)/m(см.)
Массовая доля примеси:
W(прим.) = m(прим)/m(см.)
Сумма массовых долей всех компонентов, образующих смесь равна 1 или 100%.
Объемная доля газа (или жидкости) в смеси газов (или жидкостей) – это число, показывающее, какую часть по объему составляет объем данного газа (или жидкости) от общего объема смеси, принятого за 1 или за 100%.
Состав смеси газов или жидкостей, выраженный в объемных долях, называется составом смеси по объему.
Например, состав смеси сухого воздуха:
- По объему: Wоб(N2) = 78,1%, Wоб(O2) = 20,9%
- По массе: W(N2) = 75,5%, W(O2) = 23,1%
Этот пример наглядно демонстрирует, что во избежание путаницы, корректно будет всегда указывать, по массе или по объему указано содержание компонента смеси, ведь эти цифры всегда отличаются: по массе в воздушной смеси кислорода получается 23,1 %, а по объему – всего 20,9%.
Растворы можно рассматривать как смеси из растворенного вещества и растворителя. Поэтому их химический состав, как и состав любой смеси, можно выражать в массовых долях компонентов:
W(раств. в-ва) = m(раств. в-ва)/m(р-ра),
где
m(р-ра) = m(раств. в-ва) + m(растворителя)
или
m(р-ра) = p(р-ра)·V(р-ра)
Состав раствора, выраженный через массовую долю растворенного вещества (в %), называется процентной концентрацией этого раствора.
Состав растворов жидкостей в жидкостях (например, спирта в воде, ацетона в воде) удобнее выражать в объемных долях:
Wоб%(раств. ж) = V(раств.ж)· V(р-ра)·100%;
где
V(р-ра) = m(р-ра)/p(р-ра)
или приближенно
V(р-ра) ≈ V(H2O) + V(раств. ж)
Например, содержание спирта в винно-водочных изделиях указывают не в массовых, а в объемных долях (%) и называют эту цифру крепостью напитка.
Состав растворов твердых веществ в жидкостях или газов в жидкостях в объемных долях не выражают.
Индивидуальное химическое вещество
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ ( их, учитывая различные аллотропные модификации, насчитывается около 500) и очень многочисленную группу сложных веществ.
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ ( их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ.
|
Определение фракционного состава нефтепродуктов. |
Перегонять индивидуальные химические вещества можно в любом аппарате, так как результаты перегонки определяются не конструкцией аппарата, а постоянной температурой кипения этих однородных жидкостей. При разгонке же нефтепродуктов, кипящих в широких температурных интервалах, конструкция аппарата и способ разгонки существенно влияют на результаты определения.
Перегонять индивидуальные химические вещества можно в любом аппарате, так как результаты перегонки определяются не конструкцией аппарата, а постоянной температурой кипения этих однородных жидко стей. При разгонке же нефтепродуктов, кипящих в широких температурных интервалах, конструкция аппарата и способ разгонки существенно влияют на результаты определения. Поэтому все нефтепродукты разгоняют в строго стандартных условиях в специальных аппаратах, видоизменяемых в зависимости от характера испытываемого нефтепродукта.
К индивидуальным химическим веществам не могут быть причислены ионы, хотя они и существуют в растворах в виде самостоятельно перемещающихся кинетически независимых частиц.
Компонентом называют индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из нее и существовать самостоятельно.
Включает названия индивидуальных химических веществ, их групп и классов, а также принципы и правила составления этих названий. Часто названия конкретных соединений обусловлены особенностями языка и историческими традициями.
Включает названия индивидуальных химических веществ, их груш и классов, а также принципы и правила составления этих названий. Часто названия конкретных соединений обусловлены особенностями языка и историческими традициями.
Растворитель, представляющий собой индивидуальное химическое вещество или смесь веществ, исследуется в соответствии с обычными методами анализа органических соединений.
Многообразие подлежащих контролю индивидуальных химических веществ и их смесей, загрязняющих воздух, требует совершенствования организации гигиенического нормирования и создания средств контроля на основе современной аналитической техники. Наиболее прогрессивен автоматический анализ состояния воздушной среды, позволяющий непрерывно, надежно и с достаточной точностью определять концентрации вредных и взрывоопасных веществ в воздухе. Для этой цели предназначены автоматические газоанализаторы и сигнализаторы предельно допустимых и довзрывных концентраций химических веществ, применяемые как самостоятельно, так и в качестве датчиков в системах автоматического газового анализа, автоматической защиты и сигнализации.
Ионит не является индивидуальным химическим веществом, а представляет собой многокомпонентную систему, содержащую высокомолекулярные соединения с различными молекулярными весами; установить их точную химическую формулу, молекулярный вес и некоторые другие свойства пока затруднительно ввиду сложности структуры ионитов и отсутствия разработанных методов исследования.
Полимеры представляют собой не строго индивидуальные химические вещества, а смеси веществ несколько различающейся степени полимеризации ( так называемых полимеров-гомологов), так что практически можно говорить лишь о некоторой средней степени полимеризации. Так как различные полимеры-гомологи имеют различные температуры плавления ( чем выше степень полимеризации, тем выше и температура плавления), полимеры не имеют резко выраженной температуры плавления, которая свойственна низкомолекулярным веществам, а переходят из твердого состояния в жидкое при нагреве постепенно, на протяжении некоторого температурного интервала размягчения, поэтому для полимеров значение температуры размягчения ( см. § 5 — 3) определяют с помощью условных методов.
Экспериментально концентрационные пределы воспламенения индивидуальных химических веществ и смесей определяют на приборе КП ВНИИПО.
Указанные иониты не представляют собой индивидуальных химических веществ.
Примеры чистых веществ
- Чистый гелий. Содержалась в газообразное состояние при заполнении баллонов для вечеринок или среди компонентов ядерных реакций водорода, поскольку он благородный газ, то есть газа с очень низкой реакционной способностью, который, следовательно, обычно не соединяется с другими веществами с образованием новых химических структур.
- Чистая вода. Часто называют водой дистиллированный, его получают с помощью лабораторных процессов, чтобы избежать разбавления любых других веществ в окружающей среде (поскольку вода является крупнейшим известным растворителем). Таким образом, вода состоит исключительно из атомов водорода и кислорода (H2О), не более того.
- Чистое золото. Чистое золото весом 24 карата — это уникальный элементный блок, состоящий исключительно из атомов золота (Au).
- Бриллианты. Хотя это может показаться не так, но алмаз, один из самых твердых материалов, состоит из атомы изготовлены только из углерода (C) и расположены таким образом, что их связи практически не рвутся.
- Сера. Этот элемент периодической таблицы содержится во многих простых или сложных веществах, так как это очень реактивный элемент. Таким образом, мы можем назвать кислота серная (H2ЮЗ4) как чистое вещество, несмотря на то, что оно содержит атомы водорода, серы и кислорода, поскольку они ведут себя как одно-единственное вещество.
- Озон. Соединение, которое редко встречается в нашей повседневной среде, но изобилует давлением и температурами высоких слоев атмосферы, представляет собой озон. Он состоит из молекула похож на кислород, но с тремя атомами этого элемента (O3) и часто используется именно для очистки воды.
- Бензол (C6ЧАС6). А углеводород, то есть соединение атомов углерода и водорода, бесцветное, без запаха, легковоспламеняющееся и токсичное, но доступное в чистом виде, с сохранением его свойств и реакций.
- Хлорид натрия (NaCl). Поваренная соль, та, что у нас дома, представляет собой чистое сложное вещество. Он состоит из двух элементов: хлора и натрия. С другой стороны, когда мы добавляем его в суп, он будет частью довольно сложной смеси.
- Двуокись углерода (CO2). Газ, который мы выделяем после дыхания и который необходим растениям для фотосинтеза. Состоящий из углерода и кислорода, он обычно растворяется (смешивается) в атмосфере вместе с другими газами, но когда его забирают на заводах или производят в лаборатории, он находится в чистом виде.
- Графитовый. Еще один чистый вид углерода, похожий на алмаз химически, хотя и не так физически. Он состоит только из атомов углерода с гораздо более слабым и более податливым молекулярным строением, чем алмазы.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Задания
ЗАДАНИЕ 1
Обязательный атрибут множества детективных произведений сильнейший яд — цианистый калий, точнее, цианид калия. Приведите примеры свойств других веществ, которые используются в литературных произведениях.
Показать ответ
Скрыть ответ
Например, в литературном произведении Артура Конан Дойля «Собака Баскервилей» у собаки светилась пасть и глаза. Для этого было использовано такое вещество как белый фосфор, который светится в темноте.
ЗАДАНИЕ 2
Какое понятие более широкое — «химический элемент» или «простое вещество»? Дайте доказательный ответ.
Показать ответ
Скрыть ответ
«Химический элемент» является более обширным понятием, чем «простое вещество». Объясняется это тем, что химический элемент может образовывать много разных простых веществ. Например, химический элемент кислород может образовывать простые вещества: кислород $О_2$ и озон $О_3$.
ЗАДАНИЕ 3
Стальные детали в результате длительного пребывания во влажной атмосфере покрываются ржавчиной. Как называется это явление? К физическим или химическим явлениям вы его отнесете? Почему?
Показать ответ
Скрыть ответ
Процесс ржавления металла называется коррозией. Он относится к химическим процессам, так как при взаимодействии стальных деталей с влажным воздухом, на их поверхности образовывается оксид, т. е. новое вещество.
Пример 3: Аммиак
В промышленности аммиак используется для производства удобрений, пластмасс, азотной кислоты и других химических соединений. Он также применяется в процессе охлаждения и кондиционирования воздуха.
Аммиак является амфотерным веществом, что означает, что он может проявлять свойства и основания, и кислоты. Он реагирует с кислотами, образуя соли аммония, и сильными основаниями, образуя амиды. Также аммиак может образовывать химические связи с другими элементами, такими как водород, кислород и сера.
Аммиак имеет характерный запах, который можно ощутить уже при небольшой концентрации. Он также является легким газом, более легким, чем воздух.
Аммиак широко используется в лабораторных и промышленных условиях, и его свойства и реактивность делают его одним из наиболее важных и широко применяемых химических соединений.
Свойства аммиака
Молекулярная формула
NH3
Молярная масса
17.031 г/моль
Плотность газа
0.73 г/л
Температура кипения
-33.34 °C
Температура плавления
-77.73 °C
Сложные
Сложные вещества классифицируют на следующие классы:
- оксиды – состоят из двух элементов, один из которых является кислородом;
- кислоты – состоят из атомов водорода и кислотного остатка;
- основания – состоят из металла и одной или нескольких гидроксильных групп;
- соли – состоят из металла и кислотного остатка.
Отдельно выделяют амфотерные гидроксиды, которые проявляют свойства кислот и оснований. Это твёрдые вещества, являющиеся слабыми электролитами. К ним относятся гидроксиды металлов со степенью окисления +3 и +4. Исключениями являются Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
Более подробная классификация сложных веществ представлена в таблице с примерами.
|
Вид |
Номенклатура |
Химические свойства |
Пример |
|
Оксиды – ЕхОу |
Оксид элемента (степень окисления) |
Выделяют основные оксиды, которые при взаимодействии с кислотами образуют соли, и кислотные оксиды, образующие при взаимодействии с основаниями кислоты. Отдельно выделяют амфотерные оксиды, взаимодействующие с кислотами и основаниями (образуется соль) |
Na2O – оксид натрия, Fe2O3 – оксид железа (III), N2O5 – оксид азота (V) |
|
Основания – Ме(ОН)х |
Гидроксид металла (степень окисления) |
В соответствии с растворимостью выделяют щёлочи и нерастворимые в воде основания. Щёлочи взаимодействуют с неметаллами и кислотными оксидами. Нерастворимые основания взаимодействуют с кислотами и способны разлагаться при высоких температурах |
Fe(OH)2 – гидроксид железа (II), Cu(OH)2 – гидроксид меди (II), NaOH – гидроксид натрия |
|
Кислоты – HnAc |
Читается в зависимости от кислотного остатка |
Взаимодействуют с металлами, стоящими левее водорода в ряде активности, с оксидами, солями. Способны разлагаться при высоких температурах |
H2SO4 – серная кислота, HCl – соляная кислота, HNO3 – азотная кислота |
|
Соли – Мех(Ас)у |
Кислотный остаток металла (степень окисления) |
Реагируют с кислотами, щелочами, металлами и солями |
Na2SO4 – сульфат натрия, CaCO3 – карбонат кальция, KCl – хлорид калия |
Рис. 3. Список названий кислот.
Генетические связи между классами основаны на взаимном превращении веществ. При химических реакциях атомы переходят от одного вещества к другому, образуя генетические ряды (ряды превращений). Металл при присоединении кислорода образует оксид, который при взаимодействии с водой превращается в основание. Из неметалла образуется кислотный оксид, который, взаимодействуя с водой, образует кислоту. Любой генетический ряд заканчивается солью.
Что мы узнали?
Неорганические вещества включают простые и сложные соединения. Простые вещества состоят из атомов одного и того же элемента. К ним относятся металлы и неметаллы. Сложные соединения включают вещества, состоящие из нескольких элементов. К ним относятся оксиды, кислоты, основания, соли и амфотерные гидроксиды. Все вещества генетически связаны между собой. Из простого вещества можно получить более сложное вещество. Наиболее сложными веществами считаются соли.
-
/5
Вопрос 1 из 5
Индивидуальное вещество в химии: методы получения
- Синтез. Один из основных методов получения индивидуальных веществ – синтез, при котором из простых веществ (элементов или соединений) получают новое химическое соединение. Синтез может осуществляться различными способами, включая прямые реакции, реакции с образованием промежуточных соединений или реакции с использованием катализаторов.
- Расщепление сложных соединений. Иногда индивидуальные вещества можно получить путем расщепления сложного соединения на более простые. Этот метод используется, например, при получении элементов из оксидов или при расщеплении органических соединений.
- Извлечение из природных источников. Некоторые индивидуальные вещества можно получить из природных источников, таких как руды или растения. Например, алюминий может быть получен из бокситов, а эфир – из эфирного масла.
- Декомпозиция азового, методы изменения состава с сохраниением индивидуальности. Некоторые индивидуальные вещества можно получить путем декомпозиции азового соединения. Например, алмаз может быть получен путем нагревания графита в вакууме.
Каждый из этих методов имеет свои особенности и применяется в зависимости от конкретных условий и требуемого вещества.
Химическая безопасность при работе с индивидуальными веществами
При работе с индивидуальными веществами в химии необходимо соблюдать определенные меры безопасности. Химические вещества могут быть опасными для здоровья человека, поэтому необходимо принимать соответствующие меры для защиты.
Вот некоторые основные правила химической безопасности, которые следует соблюдать при работе с индивидуальными веществами:
- Носите подходящую защитную одежду, включая халат, перчатки и защитные очки. Это поможет предотвратить контакт вещества с кожей и глазами.
- Используйте химические вещества только в хорошо проветриваемых помещениях или под вытяжным шкафом. Это поможет избежать вдыхания опасных паров.
- Избегайте поглощения или проглатывания химических веществ. В случае случайного попадания вещества на кожу или в глаза, немедленно промойте их большим количеством воды.
- Храните химические вещества в специальных контейнерах правильно помеченных метками с указанием их содержимого. Это поможет избежать путаницы и неправильного использования веществ.
- Не смешивайте различные химические вещества без необходимости. Это может привести к неожиданным реакциям и возникновению опасных веществ.
- После окончания работы с химическими веществами, тщательно вымойте руки с мылом и водой.
- Имейте при себе контактный телефон службы экстренной медицинской помощи или ядовитого контролирующего центра, чтобы при необходимости можно было быстро получить помощь.
Соблюдение этих правил поможет минимизировать риски и обеспечить безопасность при работе с индивидуальными веществами в химии.
Практические задания для усвоения материала
1. Распознавание индивидуального вещества.
Представьте, что вы получили в лаборатории неизвестное вещество и ваша задача — определить, является ли оно индивидуальным. Для этого вам необходимо провести ряд экспериментов и записать результаты. Напишите полный план эксперимента, включая список используемых реактивов, приборов и методы анализа
Обратите внимание на особенности каждого эксперимента и покажите логическую связь между ними
2. Идентификация индивидуального вещества.
3. Определение массы индивидуального вещества.
Замечание: перед проведением любых экспериментов обязательно проконсультируйтесь с преподавателем или администрацией школы по поводу безопасности и мер предосторожности
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.




























