Хлорид ионы: применение
Одно из основных применений хлорид ионов связано с производством хлорида натрия (NaCl) или обычной кухонной соли. Хлорид натрия широко применяется в пищевой промышленности, в медицине для регулирования осмотического давления и в химической промышленности для производства различных химических соединений.
Хлорид ионы также нашли применение в процессах очистки воды. Хлорирование воды — один из основных методов дезинфекции, который основан на использовании хлорид ионов. Хлорирование позволяет убить бактерии, вирусы и другие микроорганизмы, обеззараживая воду для питья и промышленного использования.
Другое важное применение хлорид ионов связано с их использованием в электролитах и батареях. Хлорид ионы могут служить электролитами в различных типах батарей, таких как щелочно-галогенидные батареи, аккумуляторы и топливные элементы
Они обеспечивают перенос зарядов и обеспечивают работу этих устройств.
Хлорид ионы также используются в процессах силикатной плавки и производства стекла. Они помогают снизить температуру плавления и повысить текучесть силикатных материалов, таких как песок и каолин. Это позволяет создать различные типы стекла, используемого в оконном стекле, посуде, лабораторных пробирках и других приложениях.
Хлорид ионы нашли применение в медицине в качестве добавок в препаратах и лекарственных средствах. Они могут использоваться в качестве антисептических и антибактериальных средств, а также восполнять дефицит хлоридов в организме при определенных заболеваниях.
Кроме того, хлорид ионы используются в аналитической химии для определения наличия или концентрации различных веществ. Они могут выступать в качестве индикаторов или реагентов при проведении различных химических анализов.
Таким образом, хлорид ионы имеют широкий спектр применений в различных областях науки и промышленности. Их свойства и возможности делают их важными ингредиентами в различных процессах и продуктах, удовлетворяющих множеству потребностей общества.
В медицине
Ионы хлорида имеют важное значение в медицине и используются в различных областях медицинской практики. В основном, они применяются для поддержания нормального уровня солей и воды в организме
Хлорид ионы помогают поддерживать правильное равновесие электролитов в теле, что существенно влияет на работу клеток и тканей.
В медицине хлорид ионы используются для регулирования гомеостаза и поддержания нормальной работы органов и систем организма. Они являются важным компонентом во многих лекарственных препаратах, используемых для лечения различных заболеваний.
Например, врачи могут назначить хлорид натрия в виде инфузии или внутривенного раствора для пациентов, испытывающих дегидрацию или потерю электролитов. Также хлорид ионы могут быть использованы для обработки ран и ожогов, так как они имеют антисептические свойства и способствуют заживлению тканей.
Хлорид ионы также могут использоваться в диагностике различных заболеваний. Например, анализ уровня хлорида в крови может помочь врачам определить наличие некоторых патологий, таких как почечная недостаточность или диабет. Кроме того, хлоридные художества могут использоваться в хирургии для контроля уровня кислотности в организме пациента.
В целом, хлорид ионы играют важную роль в медицинской практике и являются важным компонентом многих лекарственных препаратов и процедур.
В промышленности
Хлор, получаемый в результате электролиза, используется для производства полимеров, пластмасс, резин, химических реактивов и других веществ, находящих широкое применение в различных отраслях промышленности.
Щелочи, получаемые при электролизе растворов хлористого натрия и хлористого калия, применяются в качестве щелочных реактивов, в производстве стекла, мыла, моющих средств, бумаги, химических удобрений и других продуктов.
Хлоридный натрий и хлоридный калий используются в пищевой промышленности как приправы, консерванты и регуляторы кислотности. Отсутствие хлоридных ионов в продуктах питания может привести к изменению их вкуса и текстуры.
Кроме того, хлоридные ионы используются в производстве бумаги, кожи, красителей, фармацевтических препаратов, металлургической промышленности и других отраслях, где требуется применение реактивных веществ и регулирование pH.
| Применение | Продукты |
|---|---|
| Производство полимеров | Пластмасса, резина |
| Производство химических реактивов | Химические реактивы |
| Производство стекла | Стекло |
| Производство мыла | Мыло, моющие средства |
| Производство бумаги | Бумага |
| Производство фармацевтических препаратов | Фармацевтические препараты |
Особенности работы и меры предосторожности[]
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л. Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,03 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Встречается в природе
В природе хлориды обнаруживаются в основном в морской воде, которая содержит 1,94% хлоридов. Меньшие количества, хотя и в более высоких концентрациях, встречаются в некоторых внутренних морях и в подземных рассольных колодцах, таких как Большое Соленое озеро, Юта и Мертвое море, Израиль. Большинство хлоридных солей растворимы в воде, поэтому хлоридсодержащие минералы обычно встречаются в изобилии только в сухом климате или глубоко под землей. Некоторые хлоридсодержащие минералы включают галит (хлорид натрия NaCl ), сильвит (хлорид калия KCl ), бишофит (MgCl 2 ∙ 6H 2 O), карналлит (KCl ∙ MgCl 2 ∙ 6H 2 O) и каинит (KCl ∙ MgSO4 ∙ 3H 2 O). Он также содержится в эвапоритовых минералах, таких как хлорапатит и содалит.
Роль в биологии
Хлорид имеет большое физиологическое значение, которое включает регулирование осмотического давления, электролитный баланс и кислотно-щелочной гомеостаз. Хлорид является наиболее распространенным внеклеточным анионом и составляет около одной трети тонуса внеклеточной жидкости.
Хлорид является важным , играющим ключевую роль в поддержании состояния клеток и передача потенциалов действия в нейронах. Он может протекать через хлоридные каналы (включая рецептор GABAA ) и переносится транспортерами KCC2 и NKCC2.
Хлорид обычно (хотя и не всегда) находится в более высокой внеклеточной концентрации, что приводит к отрицательному обратному потенциалу (около -61 мВ при 37 градусах Цельсия в клетке млекопитающего). Характерные концентрации хлорида в модельных организмах следующие: как в E. coli, так и в почкующихся дрожжах 10-200 мМ (зависит от среды), в клетках млекопитающих 5-100 мМ и в плазме крови 100 мМ.
Концентрация хлорида в крови называется хлоридом сыворотки, и эта концентрация регулируется почками. Хлорид-ион является структурным компонентом некоторых белков, например, он присутствует в ферменте амилаза. Для этих ролей хлорид является одним из основных диетических минералов (перечисленных по названию элемента хлор). Уровни хлорида в сыворотке в основном регулируются почками через множество транспортеров, которые присутствуют вдоль нефрона. Большая часть хлорида, который фильтруется клубочком, реабсорбируется проксимальными и дистальными канальцами (в основном проксимальными канальцами) за счет как активного, так и пассивного транспорта.
Коррозия
Наличие хлоридов, например в морской воде значительно ухудшает условия точечной коррозии большинства металлов (включая нержавеющие стали, алюминий и высоколегированные материалы). Вызванная хлоридом коррозия стали в бетоне приводит к локальному разрушению защитной оксидной формы в щелочном бетоне, в результате чего происходит последующее локальное коррозионное воздействие.
Угрозы окружающей среде
Повышенные концентрации хлоридов может вызвать ряд экологических последствий как в водной, так и в наземной среде. Он может способствовать подкислению водотоков, мобилизации радиоактивных почвенных металлов за счет ионного обмена, влиять на смертность и воспроизводство водных растений и животных, способствовать вторжению морских организмов в ранее пресноводную среду и мешать естественному перемешиванию озер. Также было показано, что соль (хлорид натрия) изменяет состав микробов при относительно низких концентрациях. Он также может препятствовать процессу денитрификации, микробному процессу, необходимому для удаления нитратов и сохранения качества воды, а также препятствовать нитрификации и дыханию органических веществ.
Примеры и использования
Примером является поваренная соль, которая представляет собой хлорид натрия с химической формулой NaCl. В воде она диссоциирует на ионы Na и Cl. Соли, такие как хлорид кальция, хлорид магния, хлорид калия, находят различное применение — от лечения до образования цемента.
Хлорид кальция (CaCl) 2) представляет собой соль, которая продается в форме гранул для удаления сырости из помещений. Хлорид кальция также используется для содержания грунтовых дорог и укрепления дорожных оснований при новом строительстве. Кроме того, хлорид кальция широко используется в качестве антиобледенителя, так как он эффективен для снижения точки плавления при нанесении на лед.
Примеры ковалентно связанных соединений хлориды — это трихлорид фосфора, пентахлорид фосфора и тионилхлорид, все три из которых являются реактивными хлорирующими реагентами, которые использовались в лаборатория.
Качество воды и обработка
Основным применением хлоридов является опреснение, которое включает энергоемкое удаление хлоридных солей с получением питьевой воды. В нефтяной промышленности хлориды являются тщательно контролируемым компонентом системы бурового раствора . Повышение содержания хлоридов в системе бурового раствора может быть признаком бурения пласта с соленой водой под высоким давлением. Его увеличение также может указывать на низкое качество целевого песка.
Хлорид также является полезным и надежным химическим индикатором фекального загрязнения рек / грунтовых вод, поскольку хлорид является нереактивным растворенным веществом и повсеместно присутствует в сточных водах и питьевой воде.. Многие регулирующие водопользование компании по всему миру используют хлорид для проверки уровней загрязнения рек и источников питьевой воды.
Пища
Хлоридные соли, такие как хлорид натрия, используются для консервировать пищу и в качестве питательных веществ или приправ.
Значение хлорид ионов для здоровья
Определение концентрации хлорид ионов в питьевой воде является одной из простых и эффективных задач для выявления превышенного содержания вредных веществ или микроорганизмов, мешающих потреблению такой воды. Существует несколько методов для повышения концентрации хлорид ионов, включая фотометрический, аргентометрический и меркуриметрический методы.
При естественной подготовке питьевой воды из природных источников, важно следить за содержанием хлорид ионов, так как их повышение может указывать на наличие промышленных или рыбохозяйственного сточных вод во водоисточниках. Концентрация хлорид ионов в питьевой воде регламентируется гигиеническими нормативами и санитарно-эпидемиологическими правилами (СанПиН)
Общие требования к содержанию хлорид ионов в питьевой воде составляют не более 350 мг/л
Концентрация хлорид ионов в питьевой воде регламентируется гигиеническими нормативами и санитарно-эпидемиологическими правилами (СанПиН). Общие требования к содержанию хлорид ионов в питьевой воде составляют не более 350 мг/л.
Появление хлорид ионов в водопроводной воде может быть связано с применением хлорида железа или кислоты при очистке воды. В таких случаях, необходимо контролировать концентрацию хлорид ионов в питьевой воде, чтобы избежать превышения допустимых нормативов.
Способы определения концентрации хлор-ионов в различных средах включают абсолютную фотометрическую и электрохимическую методы. В присутствии хлорид ионов аргентометрический метод позволяет выявить содержание хлоридов с применением нитратов и реагента Фихера.
Влияние хлорид ионов на организм
Хлорид ионы являются одними из основных компонентов жидкостей организма, включая кровь и лимфу. Они помогают поддерживать равновесие электролитов, участвуют в образовании желудочного сока и способствуют нормализации кислотно-щелочного баланса.
Высокая концентрация хлоридов может вызывать жжение и раздражение слизистых оболочек, особенно в желудке и кишечнике. Это может приводить к гастриту, язвенной болезни и другим органическим заболеваниям ЖКТ.
Уровень хлорид ионов в организме также может повлиять на сократительную функцию мышц. Недостаток хлорид ионов может вызывать мышечные судороги, слабость и утомляемость, а избыток — приводить к отекам и повышенному давлению.
Поэтому важно следить за уровнем хлорид ионов в организме и употреблять питьевую воду, соответствующую регламентирующим нормативам, чтобы поддерживать баланс электролитов и обеспечить нормальное функционирование организма
Как получить необходимое количество хлорид ионов
Получить необходимое количество хлорид ионов можно из разных источников. Один из самых простых способов — это употреблять пищу, содержащую хлориды, такие как соленые орехи, рыба, морепродукты и мясо.
Также можно получать хлорид ионы из питьевой воды с натуральным содержанием хлоридов. Питьевая вода из скважин или природных источников часто содержит достаточное количество хлорид ионов для поддержания баланса электролитов
Однако следует отметить, что не все скважины содержат приемлемый уровень хлоридов, поэтому важно проверять качество воды и поддерживать ее чистоту
В целом, хлорид ионы играют важную роль в нашем организме, поддерживая его нормальное функционирование
Однако, как и с любыми другими питательными веществами, важно соблюдать баланс и не превышать рекомендуемый уровень потребления
Последствия недостатка хлорид ионов
Недостаток хлорид ионов может привести к опасным последствиям для нашего организма. При недостатке хлорид ионов в организме может возникнуть дезорганизация водно-электролитного баланса, что может привести к различным заболеваниям.
Влияние недостатка хлорид ионов на органы
Хлорид ионы имеют важное значение для многих органов и систем организма:
| Нервная система | Хлорид ионы необходимы для нормальной работы нервной системы. Их дефицит может вызвать головные боли, раздражительность, утомляемость и депрессию. |
| Пищеварительная система | Хлорид ионы помогают в процессе переваривания пищи, регулируя работу желудка и обеспечивая нормальный уровень кислотности. |
| Кровь | Хлорид ионы участвуют в образовании крови, поддерживая оптимальную концентрацию крови и регулируя рН. |
| Почки | Хлорид ионы играют важную роль в обеспечении нормальной функции почек, участвуя в процессе регулирования обмена веществ и выведения токсинов. |
Выявление недостатка хлорид и ионов
Определить недостаток хлорид ионов в организме можно с помощью простого анализа крови или мочи. Нормальное содержание хлорид ионов в крови составляет примерно 98-106 ммоль/литр.
Если уровень хлорид ионов в организме снижается, это может быть вызвано различными факторами, такими как недостаточное потребление хлоридов с пищей, проблемы с почками или желудком, а также повышенной потерей хлорид ионов при потоотделении или при приеме осмотических слабительных и противошоковых препаратов.
Профилактика недостатка хлорид ионов
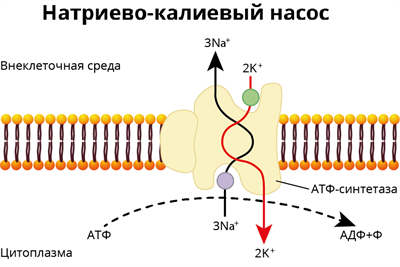
Для предотвращения недостатка хлорид ионов рекомендуется регулярное употребление пищи, богатой хлоридами. Они присутствуют в различных продуктах, таких как поваренная соль (NaCl), морепродукты, мясо, орехи, овощи и фрукты.
Также возможна хлорирование воды для обеспечения уровня хлорид ионов. Хлорирование воды является распространенным методом очистки питьевой воды от бактерий и других микроорганизмов.
Однако необходимо помнить, что излишнее потребление хлорированной воды или соли может быть опасно для здоровья и может связываться с риском развития некоторых заболеваний.
Использование хлорид-ионов в медицине
Хлорид-ионы играют важную роль в медицине и широко используются в различных процедурах и лекарственных препаратах. Их использование обусловлено способностью хлорида-иона эффективно взаимодействовать с организмом и оказывать целебное действие.
Одним из самых распространенных медицинских применений хлорид-ионов является регуляция водно-солевого баланса в организме. Хлорид-ионы входят в состав физиологических растворов, которые инъецируются пациентам для компенсации потери жидкости или восстановления электролитного баланса
Это особенно важно в случаях диареи, рвоты или недостатка натрия в организме
Кроме того, хлорид-ионы используются при проведении множества диагностических и терапевтических процедур. Они могут быть включены в состав контрастных средств, которые применяются в рентгенологии и компьютерной томографии для улучшения видимости внутренних органов. Хлорид-ионы также могут быть применены при процедурах диализа или заливании венозных линий.
Более специфическим примером медицинского применения хлорида-ионов является использование его в качестве антисептика. Хлорид-ион содержится в препаратах для обработки ран, ожогов, инфекционных заболеваний кожи и ушей. Он обладает противомикробными свойствами и может уничтожать бактерии и вирусы, что способствует заживлению и предотвращению развития инфекций.
В целом, использование хлорида-иона в медицине является неотъемлемой частью современной практики и позволяет проводить эффективное лечение различных заболеваний. Контроль над уровнем хлорида-ионов и их оптимальное использование помогают поддерживать здоровье и благополучие пациентов.
Физические и физико-химические свойства[]
| Свойство | Значение |
|---|---|
| Температура кипения | -34°С |
| Температура плавления | -101°С |
| Температура разложения(диссоциации на атомы) | ~1400°С |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144°С |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
Растворимость
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода (0°C) | 1,48 |
| Вода (20°C) | 0,96 |
| Вода (25°C) | 0,65 |
| Вода (40°C) | 0,46 |
| Вода (60°C) | 0,38 |
| Вода (80°C) | 0,22 |
| Тетрахлорметан (0°C) | 31,4 |
| Тетрахлорметан (19°C) | 17,61 |
| Тетрахлорметан (40°C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl. При 1000 К равна 2,07*10-4%, а при 2500 К 0,909%.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
В реестре CAS — номер 7782-50-5.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Что такое хлор
Хлор — это химический элемент, имеющий атомный номер 17. Он находится в группе 17 Периодической таблицы элементов. Хлор относится к р-блоку. Он относится к категории неметаллов. Группа, в которую входят хлор и другие элементы, называется группой галогенов. Поэтому хлор хорошо известен как галоген. Электронная конфигурация хлора 3s23p5. Ему не хватает одного электрона, чтобы полностью заполнить орбитали. Следовательно, атомы хлора являются очень реактивными частицами; эти атомы могут реагировать с различными типами атомов или ионов, чтобы стабилизироваться.
При комнатной температуре и давлении хлор существует в виде желто-зеленого газообразного соединения. Этот газообразный хлор имеет химическую формулу Cl2. От него удушающий запах. Как и другие химические элементы, у хлора есть изотопы. Наиболее распространенными изотопами являются хлор-35 и хлор-37. Однако хлор-35 является наиболее распространенным изотопом среди этих двух. Самая стабильная степень окисления хлора -1. Получив один электрон извне, атом хлора может получить стабильную электронную конфигурацию.

Рисунок 1: Газообразный хлор
Атомы хлора участвуют в образовании ряда химических соединений. Эти соединения являются кислотными соединениями. Гидрид хлора называется хлороводородом. Это широко используемая кислота в лабораторных масштабах. Хлор может также образовывать хлориды со многими другими металлическими элементами.
Газообразный хлор очень полезен при дезинфекции. Хлор убивает бактерии. Хлор также используется для производства ПВХ, обычного пластика. Газообразный хлор можно использовать в качестве окислителя в органической химии. Однако газообразный хлор очень токсичен.
Хлорид ионы: что это такое?
Хлорид ионы могут быть положительно или отрицательно заряженными в зависимости от того, потеряли или приобрели они один электрон. Когда атом хлора теряет один электрон, он становится положительно заряженным ионом и называется хлоридным катионом (Cl+). Когда атом хлора приобретает один электрон, он становится отрицательно заряженным ионом и называется хлоридным анионом (Cl-). Положительно заряженные ионы стремятся привлечь отрицательно заряженные ионы и наоборот, образуя стабильные химические соединения.
Хлорид ионы имеют широкий спектр применений. Они используются в процессе очистки воды для уничтожения бактерий и микроорганизмов. Также хлорид ионы используются в качестве добавок в пищу и консервантов для сохранения свежести и увеличения срока годности продуктов. Они также могут быть использованы в процессе производства пластмасс и полимеров, в медицине для поддержания электролитного баланса в организме и многих других промышленных и научных приложениях.
Хлорид ионы играют важную роль в химии и являются одним из основных элементов в окружающей нас среде
Их свойства и применение делают их незаменимыми в различных отраслях, и изучение этих ионов является важной частью образования в области химии и физики
Определение
Хлорид ионы обладают отрицательным зарядом и имеют химическую формулу Cl-. Они чаще всего образуются из атомов хлора (Cl), которые принимают дополнительный электрон. Хлориды могут также образовываться из других химических соединений путем замещения других ионов.
Хлорид ионы обнаруживаются во многих природных источниках, включая соленые океаны, морские воды и некоторые минералы. Они также широко используются в промышленности для производства хлорида натрия (NaCl), который является основным компонентом поваренной соли.
Хлорид ионы играют важную роль в теле человека, участвуя в регуляции уровня воды и электролитов. Они также используются в медицине для производства различных лекарственных препаратов и растворов.
| Хлоридный ион | Химическая формула |
|---|---|
| Хлорид натрия | NaCl |
| Хлорид калия | KCl |
| Хлорид кальция | CaCl2 |
Структура и связи
Хлорид ионы обладают связями с положительно заряженными ионами, такими как катионы металлов. Например, в хлориде натрия (NaCl) хлорид ионы образуют связи с ионами натрия (Na+). Связь между хлорид ионами и катионами может быть ионной, ковалентной или смешанной в зависимости от электроотрицательности атомов и структуры соединения.
Структура хлорид ионов обуславливает их реакционную активность. Хлорид ионы могут участвовать в различных химических реакциях, например, в образовании солей при обмене ионами или реагировании с кислотами. Кроме того, хлорид ионы играют важную роль в органической химии, например, в процессе хлорирования органических соединений.
Физические и химические свойства
Физические свойства хлорид ионов включают:
— Заряд: хлорид ионы имеют отрицательный заряд, что обусловлено наличием одного избыточного электрона. Этот заряд позволяет хлорид ионам взаимодействовать с другими заряженными и незаряженными частицами;
— Размер: хлорид ионы маленькие и могут плотно упаковываться с другими ионами или молекулами в кристаллические структуры;
— Растворимость: хлорид ионы обладают высокой растворимостью в воде и многих других полярных растворителях;
— Точка плавления и кипения: точка плавления и кипения хлорид ионов зависит от химической природы их основания.
Химические свойства хлорид ионов также играют важную роль в различных процессах и реакциях. Ниже приведены основные химические свойства хлорид ионов:
— Окислительные свойства: хлорид ионы могут выступать в роли окислителей в некоторых реакциях, передавая электроны другим веществам;
— Реакция с основаниями: хлорид ионы могут образовывать соли при реакции с основаниями, вытесняя из них другие анионы;
— Образование газообразных соединений: некоторые хлорид ионы образуют газообразные соединения, такие как хлорид водорода (соляная кислота) или хлорид аммония, которые являются важными промышленными и химическими продуктами;
— Взаимодействие с металлами: хлорид ионы могут взаимодействовать с металлами, образуя хлориды металлов, которые имеют важное применение в различных областях, включая производство электроники и фармацевтику
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
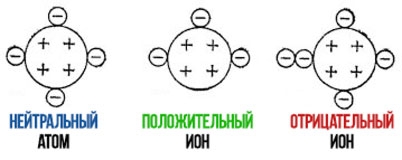
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e -), образуя положительный ион
натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион
хлора Cl — . Это записывается в виде двух реакций:
Na → Na + + e — и ½Cl 2 + e — → Cl —
Записать ½Cl 2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
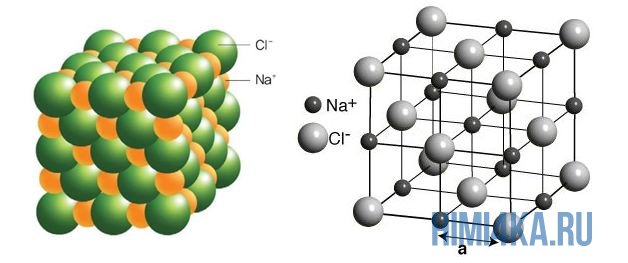
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами
. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами
являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления
— это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления
, а оттягивание электронов от атома или их полное удаление называется реакцией окисления
. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12.
Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение:
Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13.
Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение:
При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Как восполнить Cl-?
Для поддержания хлоридов и натрия на нужном уровне, необходимо скорректировать суточную норму поваренной соли и всех продуктов, ее содержащих, к стандартам, рекомендованным диетологами. Взрослым рекомендуется принимать около 2300 мг хлоридов в сутки
Также важно заботиться о правильной гидратации организма, а в случае рвоты или диареи дополнительно восполнять уровень электролитов
Основные источники хлора — соль, свекла, крупы, бобовые, овощи (помидоры, сельдерей), фрукты, мясо, яйца. Хлор также содержится в морепродуктах и пресноводной рыбе (мойва, скумбрия, хек, карп, лосось, тунец, камбала).
Таблица 1. Нормы употребления хлоридов в зависимости от возраста (европейские данные)
| Возраст, лет | Необходимое кол-во хлоридов, г\сут |
| Младенцы | 0,6 |
| 1-3 | 1,0 |
| 4-6 | 1,4 |
| 7-10 | 1,7 |
| 11-59 | 2,3 |
| беременность и период лактации | 2,3 |
| старше 60 | 1,9 |
Излишнее употребление соли опасно для здоровья. Если хлор сам по себе не большая проблема, избыток натрия дает серьезные последствия, увеличивая риск развития гипертонии и ее последствий — сердечных приступов, инсульта, проблем с почками.




























