Применение миллимолярного раствора в научных исследованиях
Миллимолярные растворы широко применяются в научных исследованиях в различных областях науки, таких как биология, биохимия, физиология, фармакология и др. Эти растворы представляют собой растворы, в которых концентрация растворенного вещества выражена в миллимолях на литр растворителя.
Миллимолярный раствор используется для точного дозирования и измерения концентрации веществ в биологических образцах или при проведении экспериментов. Он позволяет исследователям проводить качественные и количественные анализы, определение биологической активности и токсичности различных соединений.
В биохимии, например, миллимолярные растворы используются для приготовления стандартных растворов, калибровки и проверки точности аналитических методов, а также для измерения активности ферментов и других биохимических процессов. Они также могут быть использованы для проведения экспериментов по изучению влияния разных концентраций веществ на живые организмы или клетки.
В фармакологии миллимолярные растворы могут использоваться для изучения эффектов различных лекарственных препаратов на биологические объекты или для определения их фармакокинетических характеристик. Они также могут быть полезны при исследованиях токсичности веществ и оценке их безопасности.
В заключение, миллимолярные растворы являются важным инструментом в научных исследованиях, позволяющим проводить точные и управляемые эксперименты, а также получать достоверные данные о концентрации и воздействии веществ. Их использование в научных исследованиях существенно способствует развитию науки и прогрессу в различных областях знания.
Вычисление концентрации
Чтобы получить раствор, необходимо между собой смешать растворитель и растворимое. Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
- грамм на литр (г/л) — отношение массы к объёму;
- молярность (моль) — содержание растворенных элементов к объёму раствора;
- миллионная часть (г / единица раствора) — соотношение растворённых веществ к одному миллиону единиц смеси;
- проценты (%) — ответ выражается в количестве растворённой доли в граммах к ста частям раствора.
Каждый элемент характеризуется молярной массой и определяется отношением массы к числу моль. Равна она атомной массе, которую можно взять из таблицы Менделеева. Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Найдя молекулярное значение можно перейти к вычислению количества молей. Делается это с помощью формулы для молярной концентрации: масса растворённого вещества умножается на обратную молярную часть. Результат должен получиться в моль. На следующем этапе находится молярность. Полученное число молей делится на объём, измеряемого в литрах раствора. Обычно объёмом растворённой части пренебрегают.
По аналогии вычисляется концентрация и в процентном составе. Для этого нужно найти массу частей, составляющих раствор. На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
Формула расчета миллимолярного раствора
Миллимолярный раствор представляет собой раствор, в котором содержится определенное количество вещества в 1 литре растворителя. Для расчета миллимолярного раствора необходимо знать количество вещества и объем растворителя. Формула расчета миллимолярного раствора выглядит следующим образом:
- Найти мольное количество вещества, используя молекулярную массу и известное количество вещества.
- Вычислить количество вещества в граммах, используя массу молярного количества вещества.
- Разделить количество вещества в граммах на объем растворителя в литрах.
- Умножить полученное значение на 1000, чтобы получить количество вещества в миллимолях.
Таким образом, формула для расчета миллимолярного раствора выглядит следующим образом:
Где:
- Масса вещества — количество вещества, измеренное в граммах
- Молярная масса — масса одного моля вещества, измеренная в граммах на моль
- Объем растворителя — объем растворителя, измеренный в литрах
Используя данную формулу, можно легко рассчитать необходимое количество вещества, чтобы приготовить миллимолярный раствор.
Влияние температуры на растворимость
Есть три случая: растворимость большинства ионных веществ значительно увеличивается при повышении температуры, таких как NaNO 3 , KNO 3 , KCl, KClO 3 , степень растворимости нитрата калия (KNO 3 ) составляет 20 г / 100 г H 2 O. (l) при 10 градусах Цельсия. При повышении температуры до 50 градусов Цельсия растворимость увеличивается и становится 90 г / 100 г H 2 O (л).
Растворимость некоторых ионных веществ немного увеличивается при повышении температуры, например NaCl . Растворимость некоторых ионных веществ уменьшается при повышении температуры, например Ce 2 (SO 4 ) 3 .
Свойства раствора
- Частицы раствора нельзя различить невооруженным глазом или электронным микроскопом.
- Диаметр его частиц (ионов или молекул) менее 1 нм.
- Частицы, образующие раствор, распределены равномерно, поэтому раствор однороденпо составу и свойствам.
- Частицы не рассеивают луч света, проходящий через раствор .
Качественный и количественный состав растворов
Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4. Решение Для вычисления молярности и нормальности надо знать число граммов H2SO4в 1 л раствора. Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором.
Пример Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе. Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Состав растворов обычно передается содержанием в нем растворенного вещества в виде массовой доли или молярной концентрации. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означают деци-, санти- и миллимолярный раствор. В химии для количественного выражения состава растворов чаще всего используют массовую долю, молярную концентрацию (молярность) и эквивалентную концентрацию (нормальность).
Раствор, в котором массовая доля растворенного вещества равна wB (%), характеризуется тем же значением процентного содержания. На практике часто возникает необходимость в пересчете одного способа выражения состава раствора в другой, например известного процентного содержания (массовой доли в %) в молярность раствора.
Лекция «СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ»
Тема : Способы выражения концентрации растворов.
Цель: Актуализировать знания о растворах, количественных характеристиках растворов. Научиться применять знания о составе раствора для решения расчетных задач.
1.Растворы и их свойства.
2. Способы выражения концентрации растворов.
Растворы – это однородные (гомогенные) системы, состоящие из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Компонентами раствора являются растворенные вещества и растворитель. Растворитель – это компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода).
Важной характеристикой любого раствора является его состав, который определяется количеством растворенного вещества и растворителя. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называется концентрацией
Известно несколько способов выражения концентрации растворов.
1) Молярная концентрация вещества В или молярность (сВ или М) – отношение количества растворенного вещества к объему раствора:
,
где nB – количество вещества В; mB – масса вещества, г; МВ –молярная масса вещества, г/моль; V – объем раствора, л.
2) Молярная концентрация эквивалентов вещества В или нормальность (
н.отношение количества эквивалентов растворенного веществак объемураствора
где nэк(В) – количество вещества эквивалентов; mB – масса вещества, г; Мэ(В) – молярная масса эквивалентов вещества, г/моль; V – объем раствора, л.
3) Моляльная концентрация вещества В или моляльность (
отношение количестварастворенного вещества к массе растворителя
где nВ – количество растворенного вещества В; mB – масса растворенного вещества, г; mS – масса растворителя, кг; МВ — молярная масса растворенного вещества, г/моль.
Массовая доля вещества В (ω) – отношение массы растворенного вещества к массе раствора. Массовая доля ─ безразмерная величина, ее выражают в долях единицы или процентах:
где mB – масса растворенного вещества, г; m – масса раствора, г.
Если выражать массу раствора через его плотность(ρ) и объем(V), то
Молярная (мольная) доля вещества В (хВ) ─ отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, содержащихся в растворе:
где хB – молярная доля растворенного вещества, nB – количество растворенного вещества; nS – количество растворителя.
где хS – молярная доля растворителя, nB и nS – количества растворенного вещества и растворителя.
Титр раствора вещества В (ТВ) показывает число граммов растворенного вещества, содержащегося в 1 мл (см 3 ) раствора. Титр рассчитывается по формулам:
где Мэ(В) – молярная масса эквивалентов вещества,
где ωВ – массовая доля растворенного вещества, ρ – плотность раствора.
Примеры решения задач
Пример 7.1 . Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1,18 г/см 3 . Вычислить: а) массовую долю (%)H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность; д) титр; е) молярные доли H3PO4 и Н2О.
Решение . а) Для расчета массовой доли воспользуемся формулой (5):
б) Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1):
в) Молярная масса эквивалентов H3PO4 равна
г) Для определения моляльности по формуле (3) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1,18 ∙ 1000 = 1180 г.
+Масса растворителя в растворе mS = 1180 – 354 = 826 г.
моли в миллимоли
Как рассчитать моляльность?
Используйте формулу моли = масса растворенного вещества / молярная масса . Предположим, мы хотим растворить 70,128 г соли в 1,5 кг воды. поэтому моли NaCl = 70,128 г/(58,44 г/моль) = 1,2 моль. Подставьте число молей и массу растворителя в формулу моляльности.
Как рассчитать молярную концентрацию?
Для расчета молярной концентрации найдем молярная концентрация путем деления молей на литры воды, использованные в растворе. Например, уксусная кислота здесь полностью растворена в 1,25 л воды. Затем разделите 0,1665 моль на 1,25 л, чтобы получить молярную концентрацию, которая будет равна 0,1332 М.
Какая формула перевода молей в граммы?
Моли в граммы пример задачи
Решение: Узнайте молярную массу вещества (подсказка: для расчета молярной массы можно использовать только Молярную массу вещества). Молярная масса KClO3 составляет 122,548 г/моль. Умножить заданное количество молей (2,50 моль) на молярную массу (122,548 г/моль), чтобы получить граммы.
Как считать эквиваленты?
Чтобы рассчитать молярные эквиваленты для каждого реагента, разделите моли этого реагента на моли лимитирующего реагента: Обратите внимание, что молярный эквивалент бензоата натрия равен 1. Это связано с тем, что бензоат натрия является ограничивающим реагентом
Любые реагенты, используемые в избытке, будут иметь молярную эквивалентность больше единицы.
Что такое микромолярная концентрация?
Слушайте произношение. (MY-kroh-MOH-ler) Концентрация 1/1 000 000 (одна миллионная) молекулярной массы на литр (Молл).
Как рассчитать рН?
Расчет pH
pH определяется следующим уравнением: pH = -log , где обозначает молярную концентрацию ионов водорода
Обратите внимание, что мы должны взять десятичный логарифм концентрации ионов водорода, чтобы рассчитать рН
Как рассчитать M1V1 M2V2?
Вы можете найти концентрацию или объем концентрированного или разбавленного раствора, используя уравнение: М1В1 = М2В2, где М1 — молярная концентрация (моль/литры) концентрированного раствора, V2 — объем концентрированного раствора, М2 — молярная концентрация разбавленного раствора (после …
Является ли M таким же, как моль дм 3?
Единицами измерения молярной концентрации в системе СИ являются моль/м3. Однако в большей части химической литературы традиционно используется моль/дм3, или моль дм-3, т.е. то же, что моль/л. … моль/м3 = 10-3 моль/дм3 = 10-3 моль/л = 10-3 М = 1 мМ .
Что такое 1 молярный раствор?
1 молярный (М) раствор будет содержать 1,0 GMW вещества, растворенного в воде, для получения 1 л конечного раствора. Следовательно, 1М раствор NaCl содержит 58,44 г. Пример: HCl часто используется в гистохимии ферментов.
Как рассчитать концентрацию раствора?
Разделите массу растворенного вещества на общий объем раствора. Напишите уравнение С = м/В, где m — масса растворенного вещества, а V — общий объем раствора. Подставьте найденные значения массы и объема и разделите их, чтобы найти концентрацию раствора.
Каковы единицы концентрации?
Молярность (М) указывает количество молей растворенного вещества на литр раствора (моль/литр) и является одной из наиболее распространенных единиц, используемых для измерения концентрации раствора. Молярность можно использовать для расчета объема растворителя или количества растворенного вещества.
Какова формула массовой концентрации?
Для чистого химического вещества массовая концентрация равна его плотности (масса, деленная на объем); таким образом, массовую концентрацию компонента в смеси можно назвать плотностью компонента в смеси. Это объясняет использование ρ (строчная греческая буква ро), символа, наиболее часто используемого для обозначения плотности.
Пример моляльности?
Моляльность определяется как количество молей растворенного вещества в 1000 г растворителя. В отличие от молярности, моляльность не меняется с температурой, поскольку изменение температуры влияет на массу. … Пример: Рассчитайте моляльность раствора, приготовленного из 29,22 г NaCl в 2,00 кг воды.
Как рассчитать моляльность воды?
Моляльность ( m ) раствора равна моль растворенного вещества разделить на килограммы растворителя. Раствор, содержащий 1,0 моль NaCl, растворенный в 1,0 кг воды, является «одномоляльным» раствором хлорида натрия.
Какова формула повышения температуры кипения?
Температура кипения воды составляет 100 градусов по Цельсию. Уравнение для повышения температуры кипения: дельта Т = мКб.
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
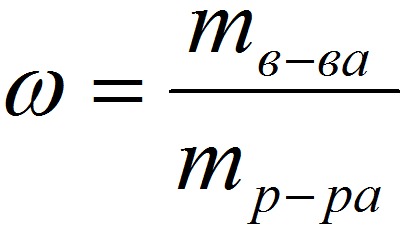
ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:
C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:
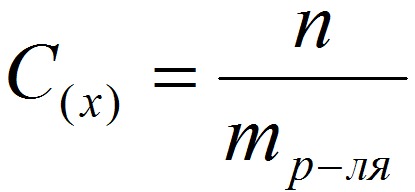
С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:
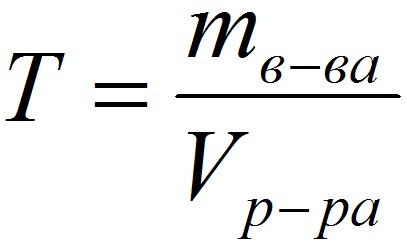
T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:
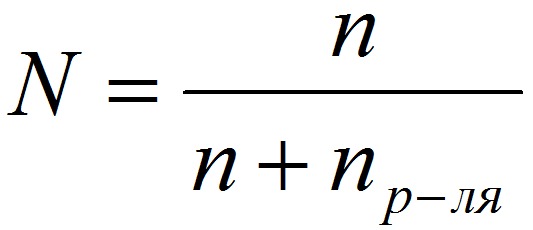
N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
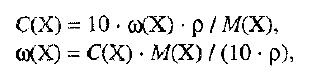
ω(X) — массовая доля растворенного вещества, в %;
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
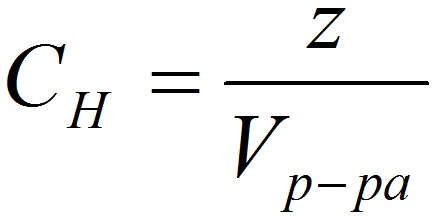
СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Растворимость вещества S — максимальная масса вещества, которая может раствориться в 100 г растворителя:
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Источник
Общие свойства растворов
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации.
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов.
Растворы. Способы выражения концентрации
Истинными
растворами называются гомогенные системы, состоящие из двух или
большего числа компонентов, состав которых может непрерывно
меняться в определенных пределах.
Агрегатное состояние растворов может быть твердым, жидким или
газообразным. Обычно термин “растворы” относят к жидким
системам. Компонент раствора, имеющий то же агрегатное
состояние, что и раствор, называют растворителем, остальные
компоненты – растворенными веществами. Это деление достаточно
условно, например в растворе, компонентами которого являются
азотная кислота и вода, растворителем и растворенным веществом
можно считать каждый из компонентов. Подобные растворы называют
взаимными, например взаимный раствор азотной кислоты и воды.
Однако в случае, когда одним из компонентов раствора является
вода, ее традиционно считают растворителем.
Содержание растворенного вещества в растворе
может быть выражено несколькими способами:
Массовая доля растворенного вещества:
отношение массы растворенного вещества к массе раствора:
где – массовая доля
растворенного вещества, – масса
растворенного вещества, – масса
раствора. Это частный случай определения массовой доли.
Концентрация (молярная концентрация,
молярность): отношение количества растворенного вещества
к объему раствора V:
Молярная концентрация имеет принятую в химии размерность
[моль/л], которая часто обозначается М и называется молярностью.
Например, концентрация раствора 5 моль/л может быть записана как
5 М и такой раствор называется пятимолярным.
Эквивалентная (нормальная)
концентрация: отношение количества эквивалентов
растворенного вещества ЭКВ к
объему V раствора:
Эквивалент – это реальная или
условная частица вещества, которая в данной кислотно-основной
реакции эквивалента (равна) одному иону водорода или в данной
окислительно-восстановительной реакции – одному электрону.
Например в реакции
H2SO4 = K2SO4 +
2H2O
эквивалентом
гидроксида калия будет молекула КОН, а серной кислоты молекулы H2SO4.
Фактор эквивалентности
fЭКВ показывает, какая доля реальной частицы
данного вещества в данной кислотно-основной реакции эквивалента
(равна) одному иону водорода или в данной
окислительно-восстановительной реакции – одному электрону.
Для приведенного примера
1
1/2
Величина, обратная фактору
эквивалентности, называется эквивалентным числом
zB:
Число частиц эквивалентов вещества
NЭ связано с числом реальных частиц N
соотношением:
Количество вещества эквивалента
равно отношению числа частиц эквивалентов к числу Авогадро:
Молярная масса эквивалента равна отношению массы вещества к
количеству вещества эквивалента:
и имеет
размерность г/моль.
Эквивалентная
концентрация имеет размерность [моль эквивалента/л] и называется
также нормальной концентрацией или нормальностью раствора и
обозначается н. Например, раствор с эквивалентной
концентрацией 0,5 моль-эквивалентов/л называется полунормальным,
его концентрация запишется 0,5 н.
Молярная концентрация и массовая доля
растворенного вещества связаны между собой. Предположим, что мы
знаем массовую долю растворенного вещества , плотность раствора и молярную массу растворенного вещества М. В качестве
вспомогательной величины возьмем объем раствора V. Тогда масса
раствора :
масса
растворенного вешества:
количество растворенного
вещества:
Подставляем выражение для количества
растворенного вещества в формулу для концентрации и сокращаем
объем раствора V:
Если из полученного соотношения
выразить массовую долю растворенного вещества, то:
Оба выражения (для концентрации и массовой доли) содержат
размерные величины, поэтому подстановка числовых значений
требует от них определенных размерностей: С[моль/л], М[г/моль],
[г/л]. Для перевода плотности из
размерности [г/мл] необходимо числовое значение умножить на
1000:
[г/л] = [г/мл]•1000
Природа растворенного вещества и растворителя
Подобно тому, как растворять подобное — это хорошо известное утверждение, которое контролирует процесс растворимости, это утверждение можно объяснить следующим образом:
Полярный растворитель, такой как вода, растворяет ионные соединения (хлорид натрия NaCl, гидроксид натрия NaOH, нитрат никеля Ni (NO 3 ) 2 ), а вода растворяет полярные соединения (хлористый водород HCl, аммиак NH 3 ).
Неполярный растворитель (органический растворитель), такой как бензол, растворяет неполярные соединения (метан, масло, жиры), а дихлорид метана растворяет неполярный материал (йод).
Растворимость некоторых веществ в полярных и неполярных растворителях
Три пробирки содержат гетерогенную смесь воды и дихлорида метана .
В первой трубке , дихлорид метана не растворяется в воде , потому что вода является полярным растворителем, в то время как дихлорид метана является неполярным веществом , в котором неполярные вещества не растворяются в полярных растворителях .
Во второй трубе , путем добавления раствора йода к этой гетерогенной смеси , растворяется в дихлорид метана, но не растворяется в воде , так как раствор йода является неполярным веществом и метан дихлорид также является неполярным растворителем, но вода является полярным растворителем , в котором неполярные вещества не растворяются в полярных растворителях, но растворяются в неполярных растворителях.
В третьей пробирке при добавлении зеленого нитрата никеля к этой гетерогенной смеси он растворяется в воде и не растворяется в дихлориде метана, потому что нитрат никеля является полярным веществом, а вода — полярным растворителем, а дихлорид метана неполярным. растворитель , в котором ионные вещества растворяются в полярных растворителях , но не растворяются в неполярных растворителях.
Масло не растворяется в воде, потому что вода является полярным растворителем, а масло — неполярным соединением. Таким образом, масло не растворяется в воде .
Масло растворимо в бензоле, потому что масло (неполярное вещество) диспергировано между молекулами бензола (неполярный растворитель) из-за слабых связей между молекулами бензола.
Сахар растворим в воде , хотя сахар является неполярным веществом, потому что молекулы воды образуют водородные связи с молекулами сахара (полярные гидроксильные группы).










![Перевести единицы: молярный [м] в миллимолярный [мм или 0.001м] • конвертер молярной концентрации • гидравлика и гидромеханика — жидкости • компактный калькулятор • онлайн-конвертеры единиц измерения](http://sarfruits.ru/wp-content/uploads/d/3/5/d3598459cba3b295be0c78fa9756b62b.jpeg)
![Перевести единицы: миллимолярный [мм или 0.001м] в молярный [м] • конвертер молярной концентрации • гидравлика и гидромеханика — жидкости • компактный калькулятор • онлайн-конвертеры единиц измерения](http://sarfruits.ru/wp-content/uploads/0/c/5/0c5436965dbbaaf1f226b71ee084507d.png)







