Почему атом электронейтрален?
Электрон — элементарная частица, обладающая отрицательным электрическим зарядом. Протон — также элементарная частица, но с положительным зарядом. Изначально, при формировании атома, количество электронов и протонов равны друг другу и создают электронейтральное состояние.
Процесс образования атома начинается с образования ядра, в котором содержатся протоны и нейтроны. Затем электроны занимают свои орбитали вокруг ядра, создавая оболочку. Электроны заполняют энергетические уровни, начиная с наименьшей энергии.
Каждая электронная орбиталь может содержать определенное число электронов: первый энергетический уровень — максимум 2 электрона, второй — 8 электронов, третий — 18 электронов и так далее. Таким образом, если атом содержит, например, 6 электронов, то первые два электрона будут занимать первый энергетический уровень, а остальные 4 — второй энергетический уровень.
Почему атом стремится быть электронейтральным? Потому что, если в атоме было бы больше или меньше электронов, чем протонов, он не был бы электронейтрален и имел бы электрический заряд. Например, если бы в атоме было больше электронов, чем протонов, он был бы отрицательно заряженным. Если бы в атоме было меньше электронов, чем протонов, он был бы положительно заряженным.
Электронейтральное состояние атома является устойчивым и обеспечивает равновесие между притяжением положительного заряда ядра и отталкиванием отрицательного заряда электронов. Благодаря электронейтральности атомы могут образовывать стабильные соединения с другими атомами, создавая разнообразие химических соединений и материалов.
Баланс зарядов
Протон, как положительно заряженная элементарная частица, находится в ядре атома. Количество протонов в атоме определяет его атомный номер, а значит, и его ядерный заряд.
Электроны, находящиеся вокруг ядра атома, обладают отрицательным зарядом. Они равномерно распределены в областях, называемых энергетическими уровнями или оболочками электронов.
Основной принцип, обеспечивающий нейтральность атома, заключается в том, что количество протонов равно количеству электронов. Таким образом, положительный заряд протонов компенсируется отрицательным зарядом электронов, и общий заряд атома оказывается равным нулю.
Благодаря балансу зарядов в атоме, он становится электронейтральным и может участвовать в химических реакциях, образовывая стабильные соединения с другими атомами.
Закон сохранения заряда
Этот закон был впервые сформулирован Кулоном в XVIII веке при изучении взаимодействия электрических зарядов. В современной науке он играет ключевую роль в объяснении электромагнитных явлений и определении свойств атомов.
Закон сохранения заряда подразумевает, что при взаимодействии заряженных частиц или объектов, общая сумма их зарядов до и после взаимодействия остается неизменной. Например, если два заряда разного знака притягиваются друг к другу и один заряд теряет некоторую часть своего заряда, то второй заряд получает этот потерянный заряд. Таким образом, закон сохранения заряда гарантирует, что всякий раз при взаимодействии зарядов мы имеем сохранение общей суммы зарядов в системе.
Этот закон имеет большое значение для понимания строения атома, поскольку атом электронейтрален. Внутри атома положительный заряд ядра с равной алгебраической суммой отрицательных зарядов электронов, что обеспечивает его электронейтральность. В результате процессов перераспределения зарядов, электроны с определенными энергетическими уровнями могут переходить между атомами и создавать химические связи.
Влияние электромагнитных сил
В атоме присутствуют положительно заряженное ядро и отрицательно заряженные электроны, которые находятся на орбитах вокруг ядра. Положительный заряд ядра притягивает электроны, создавая электростатическую силу, направленную к ядру.
Однако электроны обладают электрическим зарядом и между собой отталкиваются, создавая электромагнитную силу отталкивания. Эта сила отталкивания сбалансирована силой притяжения к ядру, что позволяет атому оставаться электронейтральным.
Если бы электромагнитная сила отталкивания превышала силу притяжения к ядру, электроны бы отлетали от ядра и атом стал бы положительно заряженным. Если бы сила притяжения превышала силу отталкивания, электроны бы притягивались к ядру и атом стал бы отрицательно заряженным.
Таким образом, сбалансированное влияние электромагнитных сил обеспечивает электронейтральность атома. Этот баланс электрических сил играет важную роль в химических и физических свойствах вещества.
Базовая модель атома и атомная теория
Все вещества состоят из частиц, называемых атомами. Атомы связываются друг с другом, образуя элементы, и содержат только один вид атома.
Атомы различных элементов образуют соединения, молекулы и объекты.
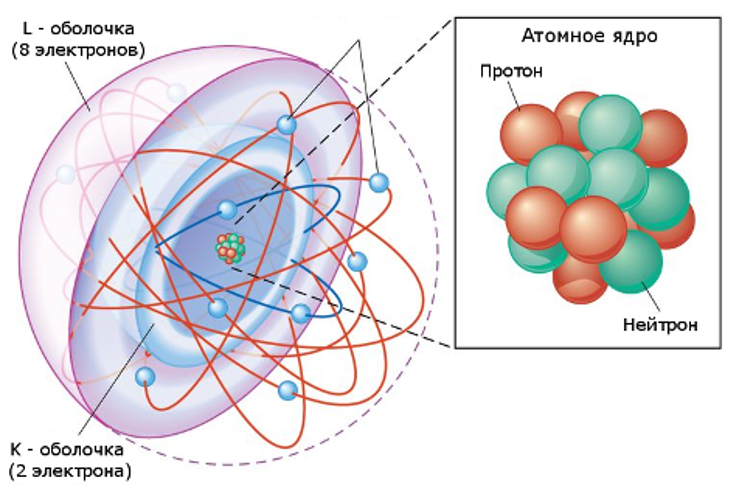
Атом — это строительный блок материи, который нельзя разбить на части с помощью каких-либо химических средств.
Ядерные реакции могут изменить атомы.
Три части атома — это протоны (положительно заряженные), нейтроны (нейтральный заряд) и электроны (отрицательно заряженные).
Протоны и нейтроны образуют атомное ядро.
Электроны притягиваются к протонам в ядре, но движутся так быстро, что падают к нему (орбите), а не прилипают к протонам.
Идентичность атома определяется его числом протонов. Это также называется его атомным номером.
Части Атома
Атомы состоят из трех частей:
Протоны: протоны являются основой атомов. В то время как атом может получать или терять нейтроны и электроны, его идентичность связана с числом протонов. Символом числа протонов является заглавная буква Z.
Нейтроны: число нейтронов в атоме обозначается буквой N. Атомная масса атома является суммой его протонов и нейтронов или Z + N. Сильная ядерная сила связывает протоны и нейтроны вместе, образуя ядро атом.
Электроны: электроны намного меньше протонов или нейтронов и вращаются вокруг них.
Основные характеристики атомов:
Атомы не могут быть разделены с помощью химических веществ. Они состоят из частей, которые включают протоны, нейтроны и электроны, но атом является основным химическим строительным материалом материи. Ядерные реакции, такие как радиоактивный распад и деление, могут разрушать атомы.
Каждый электрон имеет отрицательный электрический заряд.
Каждый протон имеет положительный электрический заряд. Заряд протона и электрона равен по величине, но противоположен по знаку. Электроны и протоны электрически притягиваются друг к другу. Как заряды (протоны и протоны, электроны и электроны) отталкиваются друг от друга.
Каждый нейтрон электрически нейтрален; иными словами, нейтроны не имеют заряда и не притягиваются электрически ни к электронам, ни к протонам.
Протоны и нейтроны имеют примерно одинаковые размеры и намного больше электронов. Масса протона по существу такая же, как у нейтрона.
Масса протона в 1840 (!) раз больше массы электрона.
Ядро атома содержит протоны и нейтроны. Ядро несет положительный электрический заряд.
Электроны движутся вне ядра; они организованы в оболочки, которые являются областью наиболее вероятного их местонахождения.
Простые модели показывают, что электроны вращаются вокруг ядра по почти круговой орбите, подобно планетам, вращающимся вокруг звезды, но реальное поведение намного сложнее.
Некоторые электронные оболочки напоминают сферы, но другие больше похожи на тупые колокольчики или другие формы.
Технически, электрон может быть найден в любом месте в пределах атома, но проводит большую часть своего времени в области, описываемой орбиталью.
Электроны также могут перемещаться между орбиталями.
Атомы очень маленькие. Средний размер атома составляет около 100 пикометров или одну десятитысячную часть метра.
Почти вся масса атома находится в его ядре; почти весь объем атома занят электронами.
Количество протонов (также известно как его атомный номер) определяет элемент.
Изменение количества нейтронов приводит к образованию изотопов. Изменение числа электронов приводит к образованию ионов. Изотопы и ионы атома с постоянным числом протонов — это вариации одного элемента.
Частицы внутри атома связаны друг с другом мощными силами.
В общем, электроны легче добавлять или удалять из атома, чем протон или нейтрон.
Химические реакции в основном включают атомы или группы атомов и взаимодействия между их электронами.
Важность электронейтральности атома
Электронейтральность атома является одним из ключевых свойств, которые обеспечивают его стабильность и способность вступать в химические реакции. Однако, зачастую, это свойство остается незамеченным или недооценивается.
Что такое электронейтральность?
Электронейтральность атома означает, что он имеет равное количество положительно и отрицательно заряженных частиц — протонов и электронов. Это означает, что общий электрический заряд атома равен нулю.
Значение электронейтральности:
1. Стабильность: Электронейтральность атома обеспечивает его стабильность и предотвращает возникновение электростатических сил между атомами, которые могут привести к их отталкиванию или притяжению. Это позволяет атомам объединяться и образовывать молекулы с более сложной структурой.
2. Химическая реактивность: Большинство химических реакций происходят из-за взаимодействия зарядов атомов. Если атом не является электронейтральным, то его заряд может повлиять на взаимодействие с другими атомами. Например, положительный заряд может привести к притяжению отрицательно заряженных атомов и образованию ионных связей.
Свойства электронейтрального атома:
- обладает нейтральным электрическим зарядом;
- вступает в химические реакции с другими атомами;
- может образовывать молекулы и соединения;
- имеет стабильную электронную конфигурацию;
- не притягивает или отталкивает другие атомы электростатическими силами.
В итоге, электронейтральность атома играет важную роль в химических реакциях и определяет его способность образовывать соединения с другими атомами. Понимание этого свойства помогает лучше понять и объяснить многие процессы, происходящие на молекулярном уровне.
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.

Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.

Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.

Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.1) Li 2) Ca 3) N 4) Ne 5) HРешение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ca — элемент IIA группы (1—1-2-3-2-1-0), значит, у него нет неспаренных электронов.N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.Ne — элемент VIIIA группы (1-0-1-2-3-2-1-), значит, у него нет неспаренных электронов.H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
Причины атомной электронейтральности
- Закон сохранения заряда: в природе заряды не появляются из ничего и не исчезают. Атом старается сохранять электронейтральность, чтобы следовать этому закону.
- Протонная и электронная заряды равны по величине, но протоны находятся в ядре и не могут двигаться, в то время как электроны могут перемещаться по областям вокруг ядра. Такая конфигурация обеспечивает общую электронейтральность атома.
- При нарушении электронейтральности атом получает возможность притягивать или отталкивать другие атомы или ионы, что может привести к возникновению химических реакций или изменению свойств вещества.
- Вся материя во Вселенной стремится к электронейтральности, так как это состояние обеспечивает более стабильную форму существования.
Все эти факторы объясняют, почему атомы стремятся сохранять электронейтральность, чтобы обеспечить стабильность и привлекательность для окружающей среды.
Присутствие равного количества электронов и протонов
Атомы считаются электронейтральными, потому что они содержат одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов. Протоны и электроны имеют равную, но противоположную по знаку элементарную заряду.
Протоны находятся в ядре атома и определяют его химические свойства. Они имеют положительный заряд, противоположный заряду электронов. Количество протонов в атоме определяет его атомный номер и позволяет классифицировать вещество в периодической системе элементов.
Электроны находятся вокруг ядра атома в области, называемой электронной оболочкой. Они обладают отрицательным зарядом и движутся по определенным орбитам, называемым энергетическими уровнями или оболочками. Количество электронов в атоме равно количеству протонов и обеспечивает электрическую нейтральность атома.
Электроны и протоны взаимодействуют друг с другом в равной, но противоположной мере. Электроны оказывают отрицательное электростатическое притяжение на протоны в ядре, равное притяжению протонов на электроны. Это позволяет поддерживать стабильность атома и его нейтральность.
Взаимодействие проекций векторов спина электрона
Спин электрона представляет собой векторную величину, характеризующую его вращение вокруг своей оси. В квантовой механике спин электрона описывается с помощью проекций спина на оси координат.
Проекция спина электрона на ось x обозначается как Sx, проекция спина на ось y — Sy, а проекция спина на ось z — Sz. Эти проекции могут принимать только определенные значения, определяемые квантовыми числами.
Взаимодействие проекций векторов спина электрона может происходить в различных физических процессах. Например, при взаимодействии с внешним магнитным полем происходит изменение проекций спина электрона.
Причина взаимодействия проекций векторов спина электрона заключается в том, что спин электрона является фундаментальной характеристикой элементарной частицы и влияет на ее поведение в различных физических системах.
Взаимодействие проекций векторов спина электрона обусловлено двумя основными факторами. Первый фактор — спин-орбитальное взаимодействие, которое возникает в результате взаимодействия спина электрона с его орбитальным движением вокруг ядра атома. Второй фактор — магнитное взаимодействие, которое обусловлено наличием магнитного момента у электрона.
Взаимодействие проекций векторов спина электрона имеет важное значение в теории сверхпроводимости, магнетизма и других областях физики. Изучение этого взаимодействия позволяет более глубоко понять природу электрона и его роль в различных физических процессах
Эффект отталкивания электронов от электромагнитных сил
Согласно закону Кулона, заряженные частицы притягиваются или отталкиваются друг от друга силой, пропорциональной квадрату расстояния между ними и обратно пропорциональной произведению их электрических зарядов. В случае атома, электроны отталкиваются друг от друга и от ядра атома. Это происходит из-за того, что каждый электрон создает электрическое поле, которое воздействует на остальные электроны, а также на ядро атома.
Поэтому, несмотря на наличие силы притяжения между электронами и ядром, эффект отталкивания электронов взаимодействует с этой силой и обеспечивает электронейтральность атома в целом. Это позволяет атому сохранять свою структуру и стабильность.
Строение атома. Атомное ядро
Атом – химически неделимая частица,
являющаяся носителем свойств химического элемента. Атом
представляет собой элекронейтральную частицу, состоящую из
положительно заряженного ядра и электронов, внутреннее строение
атома подчиняется законам квантовой механики. В
электронейтральном атоме заряд ядра полностью скомпенсирован
зарядом электронов. Если удалить из атома один или несколько
электронов, то образуется положительно заряженный ион,
заряд которого равен числу удаленных электронов. Наоборот,
прибавление к атому лишних электронов приведет к
отрицательно заряженному иону, заряд которого равен числу
добавленных электронов (в единицах элементарного заряда, см.
ниже). Атомное ядро представляет собой центральную часть атома,
в которой сосредоточена основная часть его массы. Размеры ядра в
десятки тысяч раз меньше размеров атома, масса электронов,
находящихся вне ядра составляет сотые доли процента от массы
ядра, поэтому можно считать, что масса ядра приблизительно равна
массе атома. Ядро состоит из нуклонов: протонов и нейтронов.
Основные характеристики этих частиц приведены в таблице.
Необходимо помнить, что в физике элементарных
частиц за единицу заряда принят элементарный неделимый заряд,
равный модулю заряда электрона qe=
1,6•10—19Кл.
Атомное ядро
характеризуется следующими основными параметрами:
Z – число протонов в ядре. Очевидно, что Z –
это заряд ядра, выраженный в единицах заряда электрона. Величина
заряда ядра однозначно определяет индивидуальность химического
элемента. Z также является порядковым номером химического
элемента в периодической системе и числом электронов в
электронейтральном атоме этого элемента.
N – число нейтронов в атомном ядре.
А =
Z + N – массовое число ядра. Используя эти величины атомное ядро
(или нейральный атом) можно записать так:
Так как
порядковый номер химического элемента однозначно характеризует
его индивидуальность и положение в периодической системе,
величину Z часто опускают, записывая символ химического
элемента, например:
Элемент натрий в периодической
системе один, поэтому символ Na однозначно подразумевает, что Z
= 11. Разновидности атомов одного элемента (Z одинаково),
отличающиеся массовым числом, называются изотопами. Массу
ядра атома можно рассчитать как сумму масс составляющих его
частиц – протонов и нейтронов, эту массу можно определить и
непосредственным измерением. Полученные значения масс не равны,
измеренная масса меньше суммы масс частиц, этa разность
называется дефектом массы и характеризует энергию связи нуклонов
в ядре в соответствии с формулой Эйнштейна Е = mc2 .Эта энергия предствляет
собой энергию ядерных сил, которые удерживают нуклоны в ядре.
Эти силы приблизительно в 50 раз превышают силы
электростатического отталкивания между одноименно заряженными
протонами, которые находятся в ядре. В химических расчетах массу
атома изотоп можно с достаточно большой степенью точности
считать равной массовому числу соответствующего изотопа.
Химический элемент, встречающийся в природе представляет
собой, как правило, смесь различных изотопов. Эта смесь
называется элементом есественного изотопного состава.
Изотопный состав элемента количественно характеризуется
массовыми числами изотопов и их мольными долями в природной
смеси, например природный хлор содержит два изотопа
35Cl: = 0,75 и
37Cl: = 0,25. При этом
средняя относительная атомная масса элемента естественного
изотопного состава может быть рассчитана по формуле:
в предположеннии, что масса атома совпадает с массовым числом
его ядра. Погрешность, которая при этом возникает в химии
незначима.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
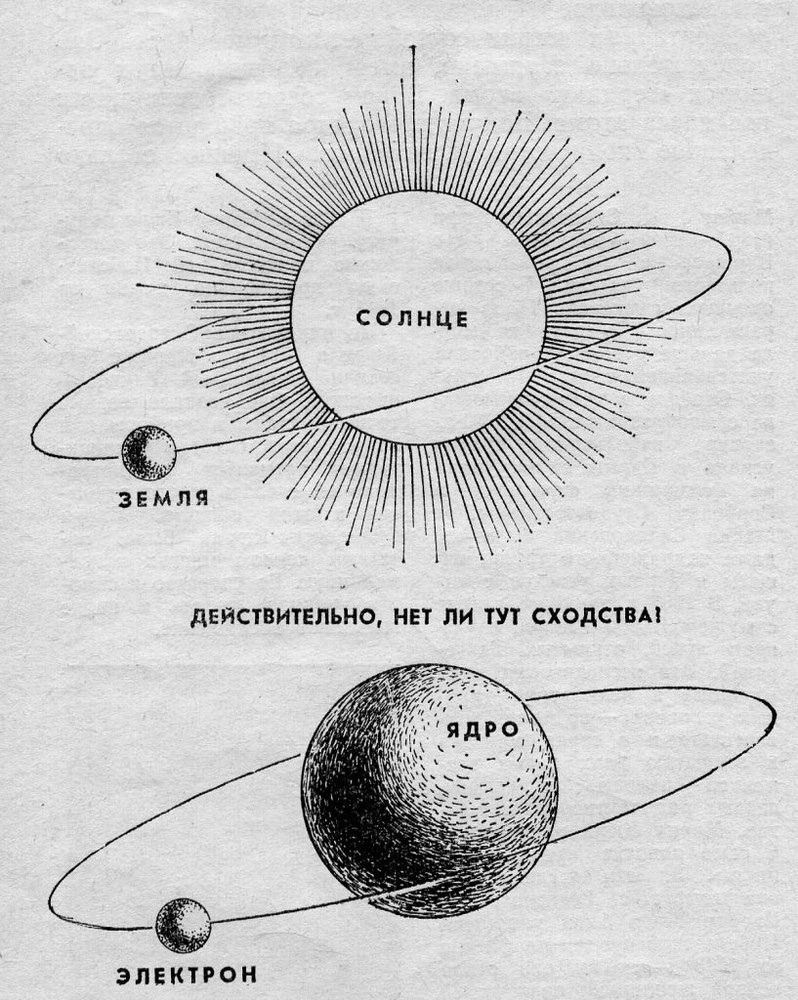 Планетарная модель
Планетарная модель
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц — кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
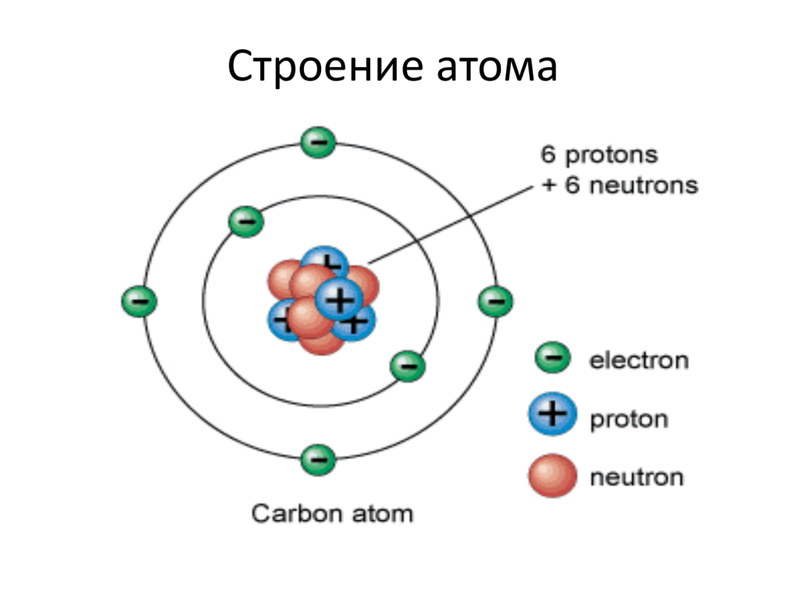 Схема строения атома
Схема строения атома
Электронная формула атома
Все на диаграммах уровней энергии довольно понятно и наглядно, но громоздко. Используя электронную конфигурацию, диаграмму можно выразить одной короткой строкой.
Рассмотрим атом углерода, который имеет два энергетических уровня, на которых расположено всего 6 электронов (2 — на внутреннем, и 4 — на внешнем):
Ниже на рисунках представлены примеры электронных формул атомов углерода и натрия (модель электронной оболочки) и их графическое изображение:
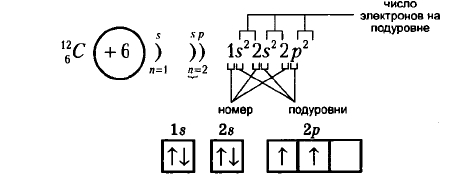 Рис. Электронная формула углерода.
Рис. Электронная формула углерода.
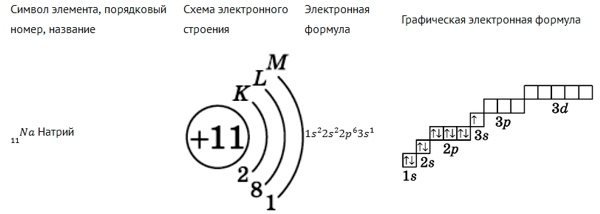 Рис. Электронная формула натрия.
Рис. Электронная формула натрия.
В электронной конфигурации указывается название орбитали энергетического уровня в верхнем индексе которой находится количество электронов, расположенных на этой орбитали.
| Сумма чисел, являющихся верхними индексами, равна порядковому номеру атома, т. е., количеству электронов в атоме. |
Электронная оболочка атома формируется согласно следующих принципов:
-
принцип минимума энергии — в первую очередь заполняются орбитали с наименьшей энергией (ближайшие к атомному ядру):
1s; 2s; 2p; 3s; 3p; 4s (3d); 4p; 5s (4d); 5p; 6s (4f) (5d); 6p; 7s; - принцип Паули — на одной атомной орбитали могут находиться не более 2 электронов с противоположными спинами (спаренные электроны);
- правило Хунда — атомные орбитали заполняются таким образом, чтобы сумма их спинов была максимальной.
Например, электронная формула для хлора имеет следующий вид: 1s22s22p63s23p5.
Порядковый номер хлора в таблице — 17. Это значит, что атом хлора содержит 17 протонов и 17 электронов. Т.е., нам на диаграмме надо (согласно правилам) расположить 17 электронов.
Как уже было сказано выше, схематически электрон отображается в виде стрелочки. Если на орбитали находятся два электрона, то они отображаются в виде двух разнонаправленных стрелок (электроны с разными спинами).
- Сначала заполняем самый низкий энергетический уровень: 1s-орбиталь. На ней размещается 2 электрона.
- Следующие 2 электрона занимают 2s-орбиталь.
- Следующий энергетический уровень: 2p-орбиталь — 6 электронов.
- Следующие 2 электрона — 3s-орбиталь.
- Оставшиеся 5 электронов располагаются на 3p-орбитали, образуя две спиновые пары (у последнего электрона пары нет).
Таким образом, диаграмма уровней энергии для хлора будет выглядеть следующим образом:
Внимательный читатель, скорее всего, обратил внимание, что порядок заполнения электронных энергетических подуровней в атомах несколько нарушен, например, сначала заполняется подуровень 4s, а только затем 3d. Данное нарушение обясняется правилом Клечковского, которое гласит, что электроны заполняют атомные уровни (подуровни) в порядке возрастания суммы (n + l), в случае, если суммы главного и орбитального квантовых чисел равны, заполнение происходит в порядке увеличения n (см
).
- Для подуровня 4s: n+l = 4+0 = 4;
- Для подуровня 3d; n+l = 3+2 = 5.
Подуровни 3d, 4p, 5s имеют равные суммы n+l=5, поэтому заполнение идет в порядке возрастания главного квантового числа: 3d→4p→5s.
Правило Клечковского имеет ряд исключений, когда близкие друг к другу подуровни незначительно отличаются энергией, в таком случае электрон стремится занять подуровень с меньшей энергией, пусть он даже будет «вышележащим», при этом «нижележащий» уровень остается незаполненным. Например 5d1 заполняется раньше, чем 4f.
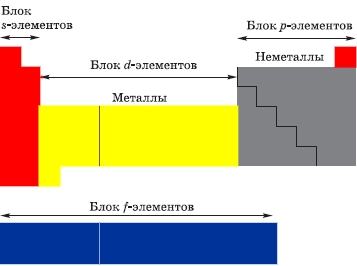
Классификация химических элементов по строению их атомов:
- s-элементы (14): электроны заполняют s-подуровень внешнего уровня — водород, гелий + первые 2 элемента каждого периода;
- p-элементы (30): электроны заполняют p-подуровень внешнего уровня — последние 6 элементов каждого периода;
- d-элементы (32): электроны заполняют d-подуровень второго снаружи уровня — элементы вставных декад больших периодов, которые находятся между s- и p-элементами;
- f-элементы (28): электроны заполняют f-подуровень третьего снаружи уровня — лантаноиды и актиноиды.
Подробнее см. Таблицу электронных конфигураций атомов химических элементов по периодам.

























![Электронная оболочка атома и спектры [1972 семишин в.и. - периодическая система химических элементов д. и. менделеева]](http://sarfruits.ru/wp-content/uploads/9/0/5/905e6387b5fb0e0339b9ac512f01d6c2.jpeg)


