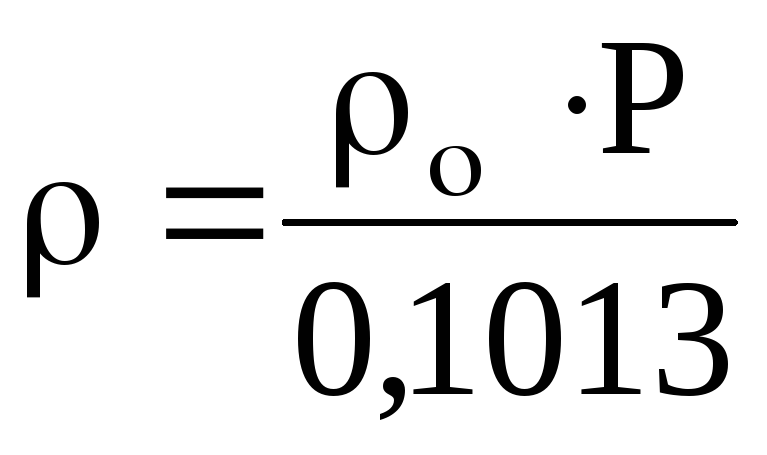Понятие плотности
Начнем статью с непосредственной записи формулы плотности вещества. Она имеет следующий вид:
ρ = m / V.
Здесь m — это масса рассматриваемого тела. Она в системе СИ выражается в килограммах. В задачах и на практике также можно встретить иные единицы ее измерения, например, граммы или тонны.
Символом V в формуле обозначен объем, который характеризует геометрические параметры тела. Измеряется в СИ он в кубических метрах, однако, также используются кубические километры, литры, миллилитры и т. д.
Формула плотности показывает, какая масса вещества содержится в единице объема. При помощи величины ρ можно оценить, вес какого из двух тел будет больше при равных объемах, или объем какого из двух тел будет больше при равных массах. Например, дерево менее плотное, чем железо. Поэтому при равных объемах этих веществ масса железа будет значительно превышать аналогичную величину для дерева.
Измерение объема газа
Для определения плотности газа по формуле, необходимо знать его объем. Измерение объема газа может быть выполнено с помощью различных методов, включая:
1. Метод контроля давления
Для использования этого метода необходимы измерительные приборы, такие как манометр и барометр. Первоначально, необходимо измерить атмосферное давление (P) с помощью барометра. Затем, при помощи манометра, измерить вскрытое давление газа в контролируемой среде (P). С помощью формулы P = P + ρgh, где ρ — плотность газа, g — ускорение свободного падения, h — высота колонки газа, можно вычислить плотность газа.
2. Метод использования градуированной колбы
В этом методе газ помещают в градуированную колбу с известным объемом, например, 100 мл. После заполнения колбы газом, его повторные измерения выполняются путем сравнения изменения уровня воды в колбе перед и после заполнения. Измерив разницу в уровне воды и зная изначальный объем колбы, можно вычислить объем газа.
3. Метод использования газовой трубки
В этом методе используются газовая трубка, компрессор и другие инструменты. Газовая трубка помещается в воду и заполняется газом. После этого объем газа можно измерить путем замера уровня воды в трубке. Используя формулу объема газа V = Ah, где A — площадь поперечного сечения трубки, h — изменение уровня воды, можно вычислить объем газа.
Измерение объема газа является неотъемлемой частью процесса определения плотности газа по водороду. Правильное выполнение этих методов позволяет получить достоверные результаты и точно определить плотность газа.
Истинная плотность. Определение. Расчетная формула. Единицы измерения.
Истинная плотность – масса единицы объема материала в абсолютно плотном состоянии (без пор и пустот).
где m
– масса материала,Va – объем материала в абсолютно плотном состоянии.
где V
— объем материала в естественном состоянии,V п – объем пор в материале.
Единицы измерения: г/см3, кг/м3.
Насыпная плотность материала. Определение. Расчетная формула. Единицы измерения.
Насыпная плотность – масса единицы объема материала в свободно насыпанном состоянии (включены межзерновые пустоты).
где m
н – насыпная масса материала,V н – насыпной объем.
где V
— объем материала в естественном состоянии,V пуст – объем межзерновых пустот.
Единицы измерения: г/см3, кг/м3.
Пустотность. Определение. Вывод расчетной формулы.
Пустотность – доля межзерновых пустот в насыпном объеме материала. Определяется только для сыпучих материалов.
,
где ρ
н – насыпная плотность материала,ρ 0 – средняя плотность материала.
На практике пустотность лежит в пределах 26,5-47,6%.
Пористость. Определение. Расчетные формулы.
Пористость – это доля заполнения объема материала порами. Общая пористость (или просто пористость) (По):
где Vпор
– объем пор в материале,V – объем материала в естественном состоянии,Vа – объем материала в абсолютно плотном состоянии (без пор),ρ 0 — средняя плотность материала,ρи — истинная плотность материала.
Пористость можно выразить и в процентах:
От величины пористости и ее характера зависят важнейшие свойства материала: плотность, прочность, теплопроводность, долговечность и др.
Пористость в материале характеризуется как открытыми, так и закрытыми порами. Открытые поры увеличивают водопоглощение и водопроницаемость материала и ухудшают его морозостойкость. Увеличение закрытой пористости за счет открытой увеличивает долговечность материала, снижает его теплопроводность.
Общая пористость складывается из открытой и закрытой: . Открытая пористость численно равна объемному водопоглощению материала (Потк
=ВV ). Определив водопоглощение по объему и пористость материала, можно легко вычислить закрытую пористость:
Коэффициент насыщения пор водой – отношение объемного водопоглощения к пористости:
Этот коэффициент изменяется от 0 (все поры в материале замкнуты) до 1 (все поры открыты). Чем больше Кн,
тем выше доля открытых пор.
Водопоглощение. Определение. Расчетные формулы. Единицы измерения.
Водопоглощение – свойство материала поглощать и удерживать воду при непосредственном контакте с ней. Водопоглощение может быть массовым и объемным:
Массовое водопоглощение– это отношение массы поглощенной материалом воды при стандартных условиях к массе сухого материала в %:
Объемное водопоглощение – это отношение объема поглощенной материалом воды при стандартных условиях к объему материала в сухом состоянии в %:
где mн
— масса материала, насыщенного водой при стандартных условиях,m – масса воздушно-сухого материала,V – объем воздушно-сухого материала, см3; — объем поглощенной воды.
Соотношение между массовым и объемным водопоглощением:
; Bv=d0Bm
d0
– относительная плотность материала (безразмерная величина, равная отношению средней плотности материала к плотности воды, равной 1 г/см3,).
Влажность. Определение. Расчетная формула. Единицы измерения.
Влажность – это содержание влаги в материале в данный момент времени. Измеряется в процентах.
или
где mвл
– масса материала в естественном состоянии,m – масса сухого материала.
Водостойкость. Определение. Расчетная формула.
Водостойкость – способность материала сохранять прочностные свойства при увлажнении. Количественной характеристикой является коэффициент размягчения – отношение прочности материала, насыщенного водой, к прочности сухого материала:
где R
сух – предел прочности сухого материала,R нас – предел прочности насыщенного материала, МПа.
Если Кр
>0,8, материал считается водостойким (например, стекло), их можно применять во влажных условиях без специальных мер по защите их от увлажнения. ЕслиКр <0,8, то материал неводостойкий (например, гипс).
Качество газа
Одним из основных показателей качества газа является его плотность. Плотность газа определяется как масса газа, содержащегося в единице объема. Этот параметр является важным для расчета объема газа и его энергетической эффективности.
Качество газа также зависит от его состава. Одним из ключевых параметров является содержание примесей, таких как кислород, азот, диоксид углерода и других газов. Наличие примесей может повлиять на физические и химические свойства газа и его возможность использования в определенных процессах.
Другим важным показателем качества газа является его теплотворная способность. Это свойство определяет энергетическую ценность газа и его способность выполнять работу или выделять тепло при сгорании. Теплотворная способность газа может быть выражена в различных единицах измерения, таких как Джоули, британских термических единицах или калориях.
Для оценки качества газа также используются физические параметры, такие как давление и температура. Эти параметры могут влиять на состояние газа и определять его способность к сжатию, расширению и переводу в жидкое состояние.
В целом, качество газа зависит от его состава, плотности, теплотворной способности и других физических параметров. Правильное определение качества газа позволяет оптимизировать его использование и обеспечить эффективность и безопасность в различных отраслях промышленности и быту.
Особенности плотности водорода и его применение
Нормальная плотность водорода составляет около 0,089 г/л при атмосферном давлении и 0 °C. По сравнению с воздухом, плотность водорода составляет всего около 14,4% от плотности воздуха.
Это свойство низкой плотности делает водород очень полезным для различных технических и научных приложений. Он широко используется как источник энергии и сырье для производства различных химических веществ.
Водород может быть использован в водородных топливных элементах, где его плотность исключительно низкая, что позволяет увеличить энергетическую эффективность таких устройств. Кроме того, водород используется в промышленности для производства аммиака, метанола, водорода и других важных химических веществ.
Также водород играет важную роль в космической промышленности. Он используется как ракетно-двигательное топливо, особенно в ракетах на базе жидкого водорода. Из-за его низкой плотности, водород обеспечивает более эффективное движение ракеты по сравнению с другими топливами.
Таким образом, плотность водорода является его особенностью, которая придает ему уникальные свойства и широкий спектр применения в различных областях.
Плотность газа и другие его физические свойства
Одной из важнейших физических свойств газообразных веществ является значение их плотности.
Данную величину обычно обозначают греческой буквой r или латинскими D и d. Единицей измерения плотности в системе СИ принято считать кг/м 3 , а в СГС – г/см 3 . Плотность газа – справочная величина, её обычно измеряют при н. у.
Зачастую, применительно к газам используют понятие «относительная плотность». Данная величина представляет собой отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диокисда углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Масс-спектрометрический метод.
Этим принципиально иным, чем все рассмотренные выше, методом определяют массу разных видов молекул или разных изотопов, находящихся в исследуемом объеме. Особую ценность он представляет для изотопного анализа. Допустим, требуется определить, содержится ли в образце метана СН4 изотоп 13 С помимо обычного изотопа 12 С. У обычного метана мол. масса равна 16, а у его изотопического варианта 17. В масс-спектре ему соответствует отдельная линия, по положению которой можно точно определить мол. массу.
Гуггенгейм Э., Пру Дж. Физико-химические расчеты. М., 1958 Некрасов Б.В. Основы общей химии. М., 1962
Относительная плотность по водороду: объяснение и примеры
Роль плотности по водороду в химических реакциях
Плотность по водороду позволяет оценить, насколько вещество расположено в реакционной смеси относительно других веществ. Это позволяет химикам определить, какая часть вещества принимает участие в реакции и какие результаты можно ожидать.
Плотность по водороду может быть выражена в единицах г/см³ или г/моль. Она позволяет сравнивать различные вещества и определить их реакционную активность. Вещества с низкой плотностью по водороду обычно обладают большой реакционной активностью, так как они содержат большое количество активных частиц, способных участвовать в химических реакциях. В то время как вещества с высокой плотностью по водороду обычно являются менее активными, так как они содержат меньшее количество активных частиц.
Роль плотности по водороду в химических реакциях заключается в том, чтобы определить, насколько вещество будет реагировать с другими веществами и какие продукты реакции будут образовываться. Это позволяет предсказывать химические свойства вещества и использовать его в конкретных процессах или при синтезе новых соединений.
Например, если вещество имеет высокую плотность по водороду, это может указывать на его способность к окислению или взаимодействию с другими веществами. Вещества с низкой плотностью по водороду могут быть инертными или стабильными. Эта информация может использоваться для выбора подходящих реагентов или определения условий реакции.
Таким образом, плотность по водороду играет ключевую роль в химических реакциях, позволяя химикам анализировать и предсказывать химические свойства вещества и его поведение в реакциях.
Растворы.
Мол. массу трудноиспаряющихся веществ определяют, исследуя свойства их растворов. Если нелетучее вещество растворить в летучем жидком растворителе, то давление паров последнего уменьшится. Соответственно температура кипения раствора возрастет, а температура замерзания понизится по сравнению с чистым растворителем. Все эти величины пропорциональны числу молей растворенного вещества в данном объеме растворителя (при условии, что раствор является разбавленным); это позволяет определить мол. массу вещества в растворе. Пусть Dр – изменение давления паров разбавленного раствора при добавлении w2 граммов растворенного вещества с мол. массой М2 в w1 граммов растворителя с мол. массой М1, р – давление паров чистого растворителя при той же температуре. Тогда
Поскольку давление паров трудно измерить с достаточной точностью, этот метод применяют довольно редко и только в усовершенствованном варианте.
Наиболее распространен метод определения мол. массы растворенных веществ, основанный на измерении температур замерзания или кипения растворов. Если DТ – понижение температуры замерзания или повышение температуры кипения раствора по сравнению с чистым растворителем, то DТ = KЧ1000w2/w1М2, где K – молярная криоскопическая или эбулиоскопическая постоянная для данного растворителя. Отсюда М2 = KЧ1000w2/w1DТ. Постоянную K можно определить экспериментально, используя растворенные вещества с известной мол. массой, или найти с помощью термодинамических расчетов. Отметим, что приведенное соотношение применимо для определения мол. масс только очень разбавленных растворов.
Методы Ландсбергера и Котрелла.
Бекман сконструировал также прибор для измерения повышения температуры кипения растворов, но здесь возникают те же проблемы, что и при измерении точки замерзания, а именно связанные с перегревом раствора. Для приближенных оценок используется метод Ландсбергера, в котором жидкость нагревают до температуры кипения, пропуская через нее пар. Для точных определений предпочтительна методика Котрелла. В ней термометр не погружают в жидкость, а помещают над ее поверхностью, так что пузырьки пара, поднимающиеся вверх, увлекают за собой жидкость, и она омывает термометр. Это позволяет избежать ошибок, связанных с перегревом.
Взаимосвязь с другими понятиями:
Плотность по водороду в химии тесно связана с рядом других понятий и физических характеристик вещества. Расчет плотности по водороду основывается на массе вещества и его объеме. Поэтому вычисление плотности требует знания молекулярной массы вещества, а также его объема, который может быть определен с помощью различных методов измерения.
Одним из важных понятий, связанных с плотностью по водороду, является молярная масса. Молярная масса — это масса одного моля вещества, выраженная в граммах. Она позволяет установить соотношение между массой и количеством вещества в системе. Для расчета плотности по водороду необходимо знать молярную массу вещества, так как она используется в формуле расчета.
Кроме того, плотность по водороду связана с понятием молярного объема. Молярный объем — это объем одного моля вещества при определенных условиях (например, при нормальных условиях — 0 градусов Цельсия и 1 атмосферном давлении). Молярный объем можно использовать для расчета объема вещества по его количеству вещества, а также для определения плотности по водороду при известной молекулярной массе.
Также взаимосвязано понятие атомной массы и плотности по водороду. Атомная масса — это относительная масса атома элемента, выраженная в атомных единицах. Зная атомные массы элементов, можно определить молекулярную массу соединения и, следовательно, вычислить плотность по водороду.
Таким образом, плотность по водороду тесно связана с массой, объемом, молярной массой, молярным объемом и атомной массой вещества. Понимание этих взаимосвязей позволяет углубить знания о составе и свойствах вещества, а также использовать плотность по водороду в различных химических расчетах и анализах.
Измерение плотности вещества
При эффективном измерении плотности вещества обычно используют специальное оборудование. Оно состоит из:
- весов;
- измерительного прибора в виде линейки;
- мерной колбы.
Если исследуемое вещество находится в твердом состоянии, то в качестве измерительного прибора используют мерку в виде сантиметра. Если исследуемое вещество находится в жидком агрегатном состоянии, то при измерениях используют мерную колбу.
Сначала предстоит измерить объем тела при помощи сантиметра или мерной колбы. Исследователь наблюдает за шкалой измерений и фиксирует получившийся результат. Если исследуется деревянный брус кубической формы, то плотность будет равна значению стороны, возведенную в третью степень. При исследовании жидкости необходимо дополнительно учитывать массу сосуда, при помощи которого проводятся измерения. Полученные значения необходимо подставить в универсальную формулу по плотности вещества и рассчитать показатель.
Для газов расчет показателя происходит очень сложно, поскольку необходимо пользоваться различными измерительными приборами.
Обычно для расчета плотности веществ используют ареометр. Он предназначен для получения результатов у жидкостей. Истинную плотность изучают при помощи пикнометра. Почвы исследуют при помощи буров Качиньского и Зайдельмана.
Моль. Закон Авогадро. Молярный объем газа

Моль (n) — кол-во вещества, содержащее столько структурных единиц (молекул, атомов, ионов и др.), сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12С 1моль вещества содержит 6,02*1023 структурных единиц (число Авогадро , NА)
Формулы, отражающие взаимосвязь объема вещества, его массы и молекулярной массы.
Где m-масса,M-молярная масса, V- объем.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро)
Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3кПа и Т0=298К) объём, равный 22,4л.
5. Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
PV = const.
6. Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим :
Обратите внимание
P0, V0 ,T0-давление объема и температуры при нормальных условиях: P0=760 мм рт. ст. или 101,3 кПа ; T0=273 К (00С)
8. Независимая оценка значения молекулярноймассы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева
pV=(m/M)*RT=vRT.(1.1)
где р — давление газа в замкнутой системе, V — объем системы, т — масса газа, Т — абсолютная температура, R —универсальная газовая постоянная.
Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1):
r = (р V)/( Т)=(101,325кПа 22.4л)/(1 моль 273К)=8.31Дж/моль.К)
Примеры решения задач
Пример 1. Приведение объема газа к нормальным условиям.
Решение.
Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p0V0/T0.
Объем газа (н.у.) равен, где Т0 = 273 К; р0 = 1,013×105 Па; Т = 273 + 50 = 323 К;
м3 = 0,32×10-3 м3.
При (н.у.) газ занимает объем, равный 0,32×10-3 м3.
Пример 2. Вычисление относительной плотности газа по его молекулярной массе.
Вычислите плотность этана С2Н6 по водороду и воздуху.
Решение.
Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (Мч) этих газов, т.е. D=М1/М2. Если М1 С2Н6 = 30, М2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна DН2 = 30/2 =15.
Относительная плотность этана по воздуху: Dвозд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение.
Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через DН2. она будет больше плотности метана, но меньше плотности кислорода:
;;
80DН2 – 640 = 320 – 20DН2 ; DН2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси МН2 = 2DН2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа.
Важно
Масса0,327×10-3 м3 газа при 130С и давлении 1,040×105 Па равна 0,828×10-3 кг. Вычислите молярную массу газа.
Решение.
Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
,
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения.
Если давление измерять в Па, а объем в м3, то R=8,3144×103 Дж/(кмоль×К).
Состав и физико-химические свойства природных газов. Классификация природных газов
Природные газы, добываемые из чисто
газовых, нефтяных и газоконденсатных
месторождений, состоят из углеводородов
гомологического ряда метана (С n Н 2n+2), а также неуглеводородных
компонентов: азота (N 2),
углекислого газа (СО 2), сероводорода
(H 2 S),
редкоземельных (инертных) газов (гелия,
аргона, криптона, ксенона), ртути. Число
углеродных атомов n в молекуле углеводородов
может достигать 17 и более.
Метан
(СН 4),
этан (С 2 Н 6)
и этилен (С 2 Н 4)
при нормальных условиях (Р = 0,1 МПа и T =
273 К) являются реальными газами. Пропан
(С 3 Н 8),
пропилен (С 3 Н 6),
изобутан (i-C 4 H 10),
нормальный бутан (n-С 4 Н 10),
бутилены C 4 Н ![]()
при атмосферных условиях находятся в
парообразном (газообразном) состоянии,
при повышенных давлениях — в жидком. Они
входят в состав жидких (сжижаемых,
сжиженных) углеводородных газов.
Углеводороды, начиная с изопентана
(i-C 5 H 12)
и более тяжелые (17 > n > 5) при атмосферных
условиях находятся в жидком состоянии.
Они входят в состав бензиновой фракции.
Углеводороды, молекула которых состоит
из 18 и более атомов углерода (отC 18 H 38),
расположенных в одну цепочку, при
атмосферных условиях находятся в твердом
состоянии.
Природные газы подразделяются на три
группы:
1. Сухой газ, свободный от тяжелых
углеводородов, добываемый из чисто
газовых месторождений.
2. Смесь сухого газа, пропанобутановой
фракции (сжиженного газа) и газового
бензина, добываемые вместе с нефтью.
3. Сухой газ и жидкий углеводородный
конденсат, добываемые из газоконденсатных
месторождений.
Углеводородный конденсат состоит из
большого числа тяжелых углеводородов,
из которых можно выделить бензиновые,
лигроиновые, керосиновые, а иногда и
более тяжелые маслянистые фракции.
Следует отметить, что в промышленности
используются искусственные газы,
полученные из твердых топлив (горючие
сланцы, бурый уголь и пр.).
Способы определения молярной массы газов
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т).
1. По закону Авогадро и следствиям из него
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙10 23 моль -1 ).
Следствие 2 при нормальных условиях (н.у.) (Р = 10 5 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM).
Зная массу m (г) какого-либо объема газа при н.у. и его объем V (л), можно рассчитать его молекулярную массу.
| . | (2.3.1) |
Следствие 3 массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
| . | (2.3.2) |
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
| . | (2.3.3) |
Обычно плотность газа определяют по отношению к водороду (DH2) или воздуху (
.
| · 2, | (2.3.4) |
| М возд.= ·29. | (2.3.5) |
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
| n , | (2.3.6) |
где N – количество структурных единиц в системе;
| n , | (2.3.7) |
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
| , | (2.3.8) |
| тогда молекулярную массу газа рассчитывают по формуле: . | (2.3.9) |
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Источник
Методы измерения плотности газа
Один из основных методов — гравиметрический метод, основанный на измерении массы газа. Для проведения эксперимента необходимо знать объем газа при определенной температуре и давлении. После этого определяется масса газа с помощью весов, а плотность рассчитывается по формуле. Данный метод является классическим и используется в научных и промышленных лабораториях.
Второй метод — объемный метод. Он основан на измерении объема газа и приложении к нему закона Гей-Люссака, который устанавливает пропорциональность между объемом газа и его температурой и давлением. Для рассчета плотности газа достаточно знать его объем, температуру и давление, а также воспользоваться формулой. Этот метод удобен в использовании и обычно применяется в бытовых условиях.
Также существует метод определения плотности газа с помощью поплавковых тел. Этот метод основан на законе Архимеда и используется для измерения объема газа. Поплавок, погруженный в газ, будет подниматься или опускаться в зависимости от плотности газа. Применение данного метода позволяет получить точные результаты и применяется в специализированных лабораториях и промышленности.
Каждый из этих методов имеет свои преимущества и недостатки, и выбор метода зависит от конкретной задачи и условий эксперимента
Важно соблюдать все требования и рекомендации при проведении измерений, чтобы получить достоверные данные
Особенности водорода
Водород обладает несколькими уникальными свойствами:
- Легкость: Водород является наиболее легким из всех элементов. Его атомная масса составляет приблизительно 1 г/моль.
- Высокая плотность энергии: Водород обладает высокой плотностью энергии. При сжигании водород может освободить большое количество энергии в виде тепла и света.
- Воспламеняемость: Водород является весьма воспламеняемым веществом. Даже небольшое количество искры или огня может вызвать взрыв, если водород находится в смеси с воздухом.
- Химическая активность: Водород может образовывать химические соединения с большинством других элементов. Например, он образует воду в результате реакции с кислородом.
- Использование в различных отраслях: Водород имеет широкий спектр применений в различных отраслях, таких как энергетика, пищевая промышленность, производство химических веществ и прочее.
Благодаря своим уникальным свойствам, водород играет важную роль в различных науках и технологиях. Он является основным источником энергии в солнечной системе и является перспективным альтернативным источником энергии на Земле. Более того, водород используется как ракетное топливо и материал для производства водородных бренчлей. Водород также используется в процессе производства аммиака, который является одним из основных ингредиентов удобрений.
Относительная плотность газа
Относительная плотность газа – сравнение относительной молекулярной или молярной массы одного газа с таким же показателем другого газа. Как правило, он определяется по отношению к самому легкому газу – водороду. Также часто газы сравнивают с воздухом.
Для того чтобы показать, какой газ выбирается для сравнения, перед символом относительной плотности исследуемого добавляют индекс, а само название записывают в скобках. Например, DH2(SO2). Это означает, что плотность оксида серы была рассчитана по водороду. Читается это как «плотность оксида серы по водороду».
Чтобы рассчитать плотность газа по водороду, необходимо с помощью периодической таблицы определить молярные массы исследуемого газа и водорода. Если это хлор и водород, то показатели будут выглядеть так: M(Cl2) = 71 г/моль и M(H2) = 2 г/моль. Если плотность водорода разделить на плотность хлора (71:2), в результате получится 35,5. То есть хлор в 35,5 раз тяжелее, чем водород.
Относительная плотность газа от внешних условий никак не зависит. Это объясняется всеобщими законами состояния газов, которые сводятся к тому, что изменение температуры и давления не приводит к изменению их объема. При любых изменениях этих показателей измерения производятся совершенно одинаково.
Для определения плотности газа опытным путем понадобится колба, куда его можно будет поместить. Колбу с газом необходимо взвесить дважды: первый раз – откачав из нее весь воздух; второй – наполнив ее исследуемым газом. Также заранее необходимо измерить объем колбы.
Сначала нужно рассчитать разность масс и разделить ее на значение объема колбы. В результате получится плотность газа по заданным условиям. С помощью уравнения состояния можно высчитать нужный показатель при нормальных либо идеальных условиях.
Узнать плотность некоторых газов можно по сводной таблице, в которой есть готовые сведения. Если газ занесен в таблицу, то брать эту информацию можно без каких-либо дополнительных расчетов и использования формул. К примеру, плотность пара воды можно узнать по таблице свойств воды (Справочник Ривкина С.Л. и др.), ее электронному аналогу или с помощью программ типа WaterSteamPro и других.
Однако у разных жидкостей равновесие с паром наступает при различной плотности последнего. Это объясняется различием сил межмолекулярного взаимодействия. Чем выше оно, тем быстрее наступит равновесие (к примеру, ртуть). У летучих жидкостей (например, эфир) равновесие может наступить лишь при значительной плотности пара.
Плотность различных природных газов варьируется от 0,72 до 2,00 кг/м3 и выше, относительная – от 0,6 до 1,5 и выше. Самая высокая плотность у газов с наибольшим содержанием тяжелых углеводородов H2S, СО2 и N2, самая низкая – у сухих метановых.
Свойства природного газа определяются его составом, температурой, давлением и плотностью. Последний показатель определяется лабораторным путем. Он зависит от всех вышеназванных. Определить его плотность можно разными методами. Самый точный – взвешивание на точных весах в тонкостенном стеклянном баллоне.
Плотность воздуха больше этого же показателя природных газов. В практике принимают это соотношение как 0,6:1. Статическое давление воздуха уменьшается быстрее по сравнению с газом. При давлении до 100 МПа плотность природного газа способна превышать 0,35 г/см3.
Установлено, что увеличение плотности природного газа может сопровождаться увеличением температуры гидратообразования. Природный газ низкой плотности образовывает гидраты при более высокой температуре по сравнению с газами с повышенной плотностью.
В газовой промышленности измерители плотности только начинают использоваться и остается еще много вопросов, которые связаны с особенностями их эксплуатации и проверки.
Газовые смеси. Плотность газов
Под плотностью, или объёмной массой,
тела понимают отношение массы тела в
состоянии покоя к его объёму.
Плотность газа в нормальных физических условиях(при
0,1013 МПа и 273 К) можно определить по формуле
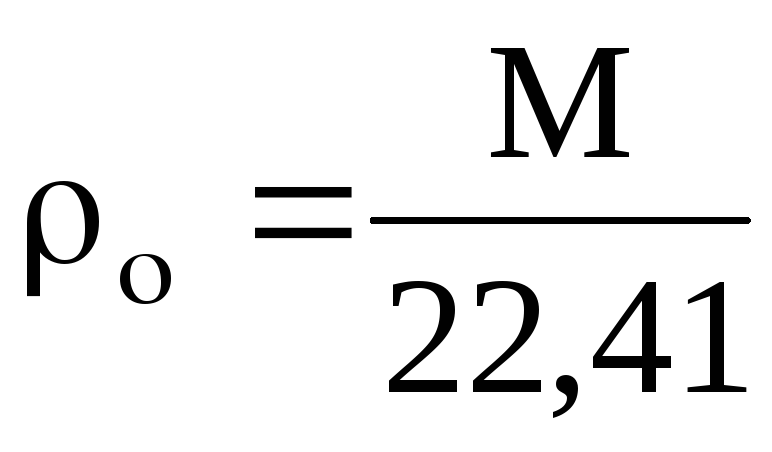 (1)
(1)
где М —
молекулярная масса.
Если плотность газа задана при давлении
0,1013 МПа, то пересчёт её на другое давление
(при той же температуре) для идеального
газа проводится по формуле
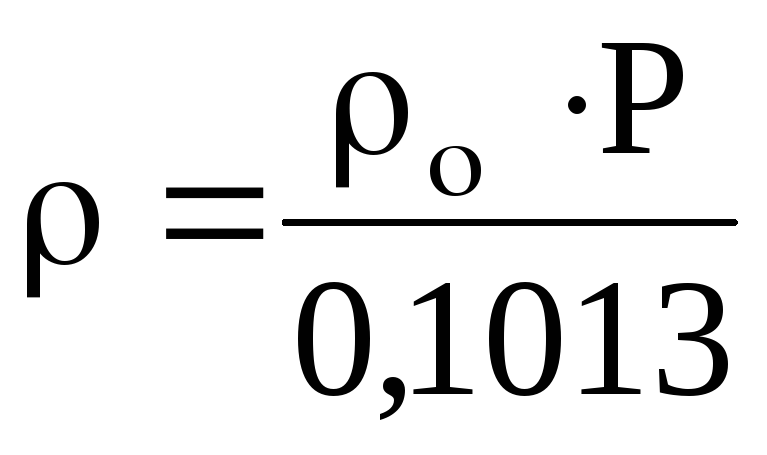 (2)
(2)
где Р – давление, МПа.
Часто для характеристики газа применяют
относительную плотность его по воздуху
при нормальных условиях (0,1013 МПа и 273 К)
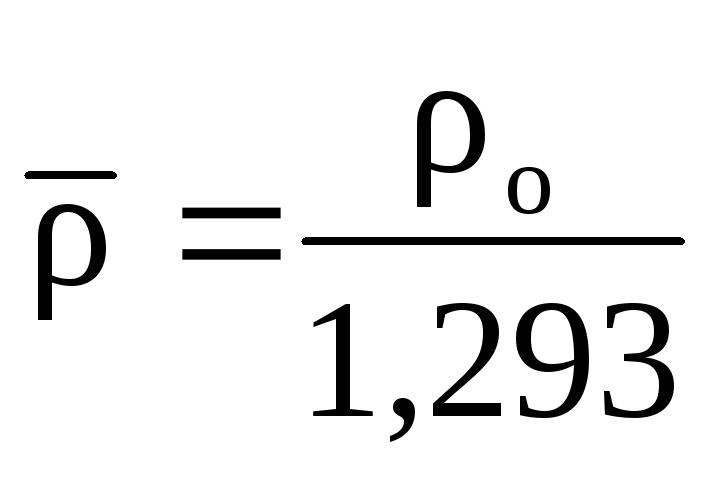 (3)
(3)
Коммерческие расчёты в газовой
промышленности проводят при стандартных
физических условиях — 0,1013 МПа и 293 К.
Различные способы измерения плотности
Метод архимедова
Один из самых простых и популярных способов измерения плотности — метод Архимеда. Для этого необходимо взять вещество, которое нужно измерить, и опустить его полностью в жидкость, плотность которой известна. Затем измерить объем вытесненной жидкости. Плотность вещества можно определить с помощью формулы:
Плотность вещества = масса вещества / объем вытесненной жидкости
Гидростатический метод
Гидростатический метод основан на законе Паскаля, который гласит, что давление, действующее на жидкость или газ в закрытом сосуде, равномерно распределяется во всех его точках. Плотность вещества можно определить с помощью формулы:
Плотность вещества = масса вещества / объем вещества
Пикнометр
Пикнометр — это специальный стеклянный сосуд с узким горлышком и пробкой. Для определения плотности вещества с помощью пикнометра необходимо:
1. Вымыть пикнометр и просушить его.
2. Заполнить пикнометр до половины спиртом или водой.
3. Точно взвесить пустой пикнометр.
4
Осторожно добавить вещество в горлышко пикнометра и закрыть пробкой
5. Взвесить пикнометр с веществом вечером снова.
Плотность вещества можно определить с помощью формулы:
Плотность вещества = (масса пикнометра с веществом — масса пикнометра) / (масса пикнометра с веществом — масса пикнометра — масса закрытого объема жидкости)
Гравиметрический метод
Гравиметрический метод основан на взвешивании образца вещества. Для этого необходимо:
1. Взвесить пустой сосуд.
2. Взвесить сосуд с образцом вещества.
Плотность вещества можно определить с помощью формулы:
Плотность вещества = масса вещества / объем вещества